题目内容
4.可以用于除去乙烷中的少量乙烯的试剂是( )| A. | 溴水 | B. | 酸性高锰酸钾溶液 | ||
| C. | 溴化钠溶液 | D. | 浓硫酸 |
分析 乙烯含有不饱和键,能使溴水褪色,除去乙烷中混有的少量乙烯时注意不能引入新的杂质,并且不能影响乙烷的量,以此解答该题.
解答 解:A.溴水可与乙烯发生加成反应,可除去杂质,故A正确;
B.乙烯被氧化生成二氧化碳,引入新杂质,故B错误;
C.与溴化钠溶液不反应,不能除去杂质,故C错误;
D.浓硫酸不能除去乙烷中的乙烯杂质,故D错误.
故选A.
点评 本题考查物质的分离、提纯,为高频考点,把握常见有机物的性质及反应现象为解答的关键,侧重烯烃性质及除杂、鉴别的考查,注意除杂的原则,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
5.下列各组中的离子,能在无色溶液中大量共存的是( )
| A. | H+、K+、CO32-、SO42- | B. | Fe3+、Na+、NO3-、SO42- | ||
| C. | Mg2+、Ba2+、OH-、NO3- | D. | K+、Mg2+、NO3-、Cl- |
12.下列物质不能把含有酸性Fe2+的溶液氧化成Fe3+的是( )
| A. | 新制氯水 | B. | 酸性高锰酸钾溶液 | ||
| C. | 往溶液中通入氧气 | D. | 往溶液中加入铁粉 |
16.有两种二元弱酸H2A与H2B.酸性强弱顺序为:酸性强弱顺序H2A>H2B>HA->HB-,(已知:H2A.Ka1=1.54×10-2,Ka2=1.02×10-2),下列说法正确的是( )
| A. | 等浓度等体积H2A与NaOH的混合溶液呈碱性 | |
| B. | H2A与少量B2-反应的离子方程式为2H2A+B2-=2HA-+H2B | |
| C. | NaHB溶液一定显酸性 | |
| D. | 等浓度等体积的NaHA与Na2B混合,混合溶液中存在这样的关系:c(A2-)>c(B2-)>c(HA-)>c(HB-) |
13.已知:4NH3(g)+3O2(g)═2N2(g)+6H2O(g)△H=-1269kJ/mol下列说法正确的是( )
| A. | 断开1 mol O-O键比断开1 mol N-N键所需能量少448 kJ | |
| B. | 断开1 mol H-O键比断开1 mol H-N键所需能量相差约72.6 kJ | |
| C. | 由以上键能的信息可知H2O的沸点比NH3高 | |
| D. | 由元素非金属性的强弱可知 H-O键比H-N键弱 |
14.向NaBr、NaI、Na2CO3的混合溶液中通入足量氯气后,将溶液蒸干并充分灼烧,得到固体剩余物的组成可能是( )
| A. | NaCl | B. | NaCl、Na2CO3 | C. | NaCl、I2 | D. | NaCl、NaI、Na2CO3 |
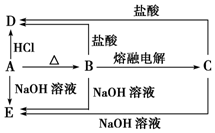 A、B、C、D、E五种物质均含有某种常见金属元素,它们的转化关系如图所示,其中B为白色难溶固体,E易溶于水.
A、B、C、D、E五种物质均含有某种常见金属元素,它们的转化关系如图所示,其中B为白色难溶固体,E易溶于水.