题目内容
20.一种新型燃料电池,它是用两根金属电极插入KOH溶液中,然后向两极上分别通入甲烷和氧气,其电极反应式为:X极:CH4+10OH--8e-═CO32-+7H2OY极:4H2O+2O2+8e-═8OH-
关于此燃料电池的说法,错误的是( )
| A. | X极为负极,Y极为正极 | |
| B. | 在标准状况下通入5.6LO2完全反应,则有0.5mol电子发生转移 | |
| C. | 工作一段时间后,KOH的物质的量减小 | |
| D. | 该电池工作时甲烷一极附近溶液pH下降 |
分析 碱性甲烷燃料电池,具有还原性的甲烷为原电池的负极,发生氧化反应,电极反应式为CH4+10OH--8e-=CO32-+7H2O,通入氧气的一极为原电池的正极,发生还原反应,电极反应式为O2+2H2O+4e-=4OH-,根据电极反应确定液的pH变化情况以及电子转移和物质量之间的关系.
解答 解:A.根据电极反应式为:X极:CH4+10OH--8e-═CO32-+7H2O,Y极:4H2O+2O2+8e-═8OH-可知X极甲烷被氧化,应为原电池的负极反应,Y极氧气得电子被还原,应为原电池的正极反应,故A正确;
B.n(O2)=$\frac{5.6L}{22.4L/mol}$=0.25mol,转移电子的物质的量为0.25mol×4=1mol,故B错误;
C.X极:CH4+10OH--8e-═CO32-+7H2O,Y极:4H2O+2O2+8e-═8OH-,则总反应:CH4+2O2+2OH-=CO32-+3H2O,氢氧化钾被消耗,物质的量减小,故C正确;
D.根据总方程式CH4+2O2+2OH-=CO32-+3H2O可知反应消耗KOH,OH-浓度减小,则pH减小,故D正确.
故选B.
点评 本题考查了燃料电池知识,燃料电池电极反应式的书写要注意结合电解质溶液书写,原料相同,电解质溶液不同,电极反应式不同,如氢氧燃料电池,电解质为酸或碱时,电极反应式就不同,题目难度中等.

练习册系列答案
相关题目
1.下列说法不正确的是( )
| A. | 分子组成相差一个或若干个CH2原子团的有机物是同系物 | |
| B. | 乙酸的官能团是羧基,乙醇的官能团是羟基 | |
| C. | 乙烯的产量通常用来衡量一个国家的石油化工发展水平 | |
| D. | 淀粉和纤维素的组成都是(C6H10O5)n,水解最终产物都是葡萄糖 |
12.下列物质不能把含有酸性Fe2+的溶液氧化成Fe3+的是( )
| A. | 新制氯水 | B. | 酸性高锰酸钾溶液 | ||
| C. | 往溶液中通入氧气 | D. | 往溶液中加入铁粉 |
10.下列物质属于电解质的是( )
| A. | 氨水 | B. | 食醋 | C. | 胆矾 | D. | 酒精 |
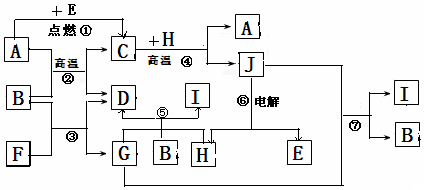
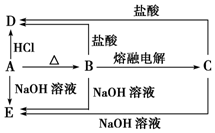 A、B、C、D、E五种物质均含有某种常见金属元素,它们的转化关系如图所示,其中B为白色难溶固体,E易溶于水.
A、B、C、D、E五种物质均含有某种常见金属元素,它们的转化关系如图所示,其中B为白色难溶固体,E易溶于水.