题目内容
某温度下,碳和水在密闭容器中发生下列反应:C(s)+H2O(g)?CO(g)+H2,CO(g)+H2O(g)?CO2(g)+H2当反应达平衡时,测得c(H2)=1.9mol/L,c(CO2)=0.9mol/L,则CO的浓度为( )
| A、0.1mol/L |
| B、0.9mol/L |
| C、1.8mol/L |
| D、1.9mol/L |
考点:化学平衡的计算
专题:化学平衡专题
分析:氢气来源C与水的反应,CO与水的反应,二氧化碳来源与CO与水的反应,平衡时CO为C与水反应生成CO减去CO与水反应消耗的CO,令碳与水反应生成的氢气的浓度为amol/L,则生成的CO为amol/L,令CO与水反应生成氢气的浓度为bmol/L,则生成的二氧化碳的浓度为bmol/L,消耗的CO浓度为bmol/L,结合氢气、CO2浓度计算.
解答:
解:令碳与水反应生成的氢气的浓度为amol/L,则生成的CO为amol/L,令CO与水反应生成氢气的浓度为bmol/L,则生成的二氧化碳的浓度为bmol/L,消耗的CO浓度为bmol/L,bmol/L=0.9mol/L,
平衡时氢气的浓度为1.9mol/L,则amol/L+bmol/L=1.9mol/L,a=1.9mol/L-0.9mol/L=1mol/L
平衡时CO的浓度为=amol/L-0.9mol/L=0.1mol/L,
故CO的浓度为0.1mol/L,
故选A.
平衡时氢气的浓度为1.9mol/L,则amol/L+bmol/L=1.9mol/L,a=1.9mol/L-0.9mol/L=1mol/L
平衡时CO的浓度为=amol/L-0.9mol/L=0.1mol/L,
故CO的浓度为0.1mol/L,
故选A.
点评:本题考查化学平衡的有关计算,难度中等,清楚反应过程是关键.

练习册系列答案
相关题目
T℃时,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列描述正确的是( )


| A、平衡时X、Y的转化率相同 |
| B、该反应的化学方程式为:X(g)+Y(g)?2Z(g) |
| C、T℃时,若起始时X为2.00 mol,Y为2.00 mol,达平衡时Y的体积分数与原平衡Y的体积分数相同 |
| D、达到平衡后,将容器体积扩大为4L,平衡向逆反应方向移动 |
已知某温度下,在100mL浓度为0.01mol/L的NaHB强电解质溶液中,c(H+)>(OH-),则下列关系式一定正确的是( )
| A、溶液的pH=2 |
| B、c(Na+)=0.01 mol/L≥c(B2-) |
| C、c (H+)?c(OH-)=10-14 |
| D、c(Na+)+c(H+)=c(HB-)+c(B2-)+c(OH-) |
化合物A是一种新型杀虫剂,结构简式如图.则下列说法正确的是( )
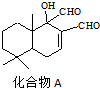

| A、化合物A分子中含有手性碳原子 |
| B、1mol化合物A与H2加成时最多可消耗1mol H2 |
| C、化合物A分子中所有碳原子共平面 |
| D、化合物A在浓硫酸作用下加热可发生消去反应 |
X、Y、Z三种气体,取X和Y按1:1的物质的量之比混合,放入密闭容器中发生如下反应:X+2Y?2Z,达到平衡后,测得混合气体中反应物的总物质的量与生成物的总物质的量之比为3:2,则Y的转化率最接近于( )
| A、33.3% | B、40% |
| C、50% | D、66.7% |
某浓度的硝酸与过量铁粉反应,生成4.48LN2O气体(标准状况).如改与铝反应(生成NO气体),则最后可溶解铝的量是( )
| A、13.5g | B、9g |
| C、27g | D、0.33mol |
下列关于丙烯(CH3-CH=CH2)的说法正确的( )
| A、丙烯分子中3个碳原子在同一直线上 |
| B、丙烯分子存在非极性键 |
| C、丙烯分子中3个碳原子都是sp3杂化 |
| D、丙烯分子有7个σ键,1个π键 |
