题目内容
根据相关的化学原理,下列判断正确的是( )
| A、由于水中存在氢键,所以稳定性:H2O>H2S |
| B、由于非金属性F>Cl>Br>I,所以酸性:HF>HCl>HBr>HI |
| C、分散质粒子直径:Fe(OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液 |
| D、若R2-和M+的电子层结构相同,则原子半径 R>M |
考点:含有氢键的物质,分散系、胶体与溶液的概念及关系,元素周期律的作用
专题:基本概念与基本理论
分析:A.氢键与稳定性无关;
B.氢化物的酸性与元素的非金属性无关;
C.根据分散系中分散质微粒半径大小比较;
D.若R2-和M+的电子层结构相同,M的原子序数大,原子序数越大.
B.氢化物的酸性与元素的非金属性无关;
C.根据分散系中分散质微粒半径大小比较;
D.若R2-和M+的电子层结构相同,M的原子序数大,原子序数越大.
解答:
解:A.水中存在氢键,水的沸点高,与物质的稳定性无关,而非金属性O>S,所以稳定性为H2O>H2S,故A错误;
B.氢化物的酸性与元素的非金属性无关,酸性:HF<HCl<HBr<HI,故B错误;
C.分散系中分散质微粒半径大小关系为:浊液>胶体>溶液,所以分散质粒子的直径:Fe(OH) 3悬浊液>Fe(OH)3胶体>FeCl3溶液,故C正确;
D.若R2-和M+的电子层结构相同,M的原子序数大,而且M在下一周期,所以原子序数越大,半径越大,所以原子半径为R<M,故D错误;
故选:C.
B.氢化物的酸性与元素的非金属性无关,酸性:HF<HCl<HBr<HI,故B错误;
C.分散系中分散质微粒半径大小关系为:浊液>胶体>溶液,所以分散质粒子的直径:Fe(OH) 3悬浊液>Fe(OH)3胶体>FeCl3溶液,故C正确;
D.若R2-和M+的电子层结构相同,M的原子序数大,而且M在下一周期,所以原子序数越大,半径越大,所以原子半径为R<M,故D错误;
故选:C.
点评:本题考查知识点较多,明确物质的性质(稳定性、沸点、氧化性)的比较方法、微粒半径与原子序数的关系即可解答,题目难度不大.

练习册系列答案
相关题目
已知2SO2(g)+O2(g)?2SO3(g)△H=-197kJ/mol.在25℃时,向恒压密闭容器中通入2molSO2和1mol O2,达到平衡时放出热量a1;若25℃时在此恒压密闭容器中只通入1molSO2和0.5molO2,达到平衡时放出热量a2.则下列关系正确的是( )
| A、2a2=a1=197 kJ |
| B、197 kJ>a1=2a2 |
| C、a2>a1>197 kJ |
| D、2a2<a1<197 kJ |
在一定条件下,甲酸甲酯与水蒸气反应的热化学方程式为:HCOOCH3(g)+H2O(g)?HCOOH(g)+CH3OH(g)△H=+40.8kJ/mol,甲实验:在温度T1下,在2L恒容密闭系中各组分的起始物质的量如下表:
达平衡时,甲酸甲酯的浓度为3.00mol/L.
乙实验:在温度T1下,在2L恒容密闭系中只加入3.00mol HCOOCH3和3.00mol H2O,下列说法不正确的是( )
| 组分 | HCOOCH3 | H2O | HCOOH | CH3OH |
| n/mol | 8.00 | 12.00 | 1.00 | 3.00 |
乙实验:在温度T1下,在2L恒容密闭系中只加入3.00mol HCOOCH3和3.00mol H2O,下列说法不正确的是( )
| A、甲实验达到平衡时,反应吸收的热量为81.6kJ |
| B、乙实验中当HCOOCH3、H2O的浓度分别为1.00mol/L、1.00mol/L时反应达平衡状态 |
| C、乙实验中甲酸甲酯的平衡转化率大于甲实验中甲酸甲酯的平衡转化率 |
| D、若要使达到平衡时甲实验和乙实验的混合气体中甲酸的百分含量相同,可采取的措施是降低甲的温度 |
下列离子方程式书写正确的是( )
| A、硫酸亚铁的酸性溶液中加过氧化氢溶液:Fe2++H2O2+2H+═Fe3++2H2O |
| B、NaHCO3溶液中加入过量的Ba(OH)2溶液:2HCO3-+Ba2++2OH-=BaCO3↓+2H2O+CO32- |
| C、NaNO2溶液中加入酸性KMnO4溶液:2MnO4-+5NO2-+6H+=2Mn2++5NO3-+3H2O |
| D、Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-═2Fe2++I2 |
与氢气完全加成后,不可能生成2,2,3-三甲基戊烷的烃是( )
| A、HC≡CCH(CH3)C(CH3)3 |
| B、CH2=CHC(CH3)2CH(CH3)2 |
C、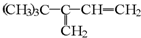 |
| D、(CH3)3CC(CH3)=CHCH3 |
氰气的化学式为(CN)2,它的性质和卤素相似,称为拟卤素,对其性质和有关化合物性质的叙述不正确的是( )
| A、HCl和HCN都易形成白雾 |
| B、(CN)2和NaOH溶液反应生成NaCN、NaCNO和H2O |
| C、NaCN和AgCN都易溶于水 |
| D、MnO2可与浓HCN溶液反应生成(CN)2 |
下列说法不正确的是( )
| A、化学反应是旧键断裂和新键形成的过程 |
| B、盖斯定律实质上是能量守恒定律的体现 |
| C、反应前后分子数不变遵循的是质量守恒定律 |
| D、溶解平衡、水解平衡和电离平衡均为动态平衡 |
一定条件下,一定体积的CO、CO2和O2组成的混合气体,点燃后完全转化为CO2,恢复到原来状态时,体积变为90mL,则原混合气体的体积可能是( )
| A、80mL | B、100mL |
| C、150mL | D、145mL |