��Ŀ����
��֪M��R�����ֳ����Ľ������ʣ�����MΪ��ɫ��������һ��������������ת����ϵ��QΪ��ɫ������
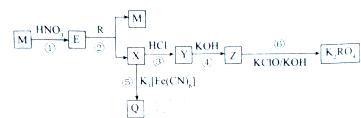
�����������ͼ�ش��й����⣺
��1��Ԫ��Rλ�����ڱ��еĵ� ���� �壮
��2������ת����ϵ�У����ڷ�������ԭ��Ӧ���� ������ţ���
��3����Ӧ��Ӧ�����ӷ���ʽ�� ��
��4������һ��M��R��Ϸ�ĩ��Ϊȷ������ɣ����ṩ4mol?L-1��FeCl3��Һ��������Ʒ�ԣ���ij����ѧϰС��ͬѧ��ʵ�������£��ٶ���Ӧǰ����Һ������䣩��
�ɢ������ݼ����֪��ԭ��Ϸ�ĩ��n��R����n��M��= ���ڢ�����Һ��Ӧ����Һ��c��Fe3+��= mol?L-1��

�����������ͼ�ش��й����⣺
��1��Ԫ��Rλ�����ڱ��еĵ�
��2������ת����ϵ�У����ڷ�������ԭ��Ӧ����
��3����Ӧ��Ӧ�����ӷ���ʽ��
��4������һ��M��R��Ϸ�ĩ��Ϊȷ������ɣ����ṩ4mol?L-1��FeCl3��Һ��������Ʒ�ԣ���ij����ѧϰС��ͬѧ��ʵ�������£��ٶ���Ӧǰ����Һ������䣩��
| ��� | �� | �� | �� | �� |
| V[FeCl3��aq��]/mL | 100 | 100 | 100 | 100 |
| ��Ϸ�ĩ����/g | 6 | 13.2 | 24 | 36 |
| ��Ӧ��ʣ���������/g | 0 | 1.28 | 12.8 | 24.8 |
���㣺������ƶ�
ר�⣺�ƶ���
��������֪M��R�����ֳ����Ľ������ʣ�����MΪ��ɫ���ж�MΪCu����EΪCu��NO3��2��QΪ��ɫ������˵��Y�к��������ӣ�E+R=M+X�����û���Ӧ��֤��RΪFe��XΪFe��NO3��2����X�м������ᣬ����Y����Fe3+������KOH������ZΪFe��OH��3���ɷ�Ӧ��֪����������ΪK2FeO4���Դ˽���1����2����3����
��4������ʵ���������ݣ���Ϸ�Ӧ��ʵ�ʷ���������������ԭ��Ӧ�Ĺ��ɣ�������������ͭ���ܷ�Ӧ�����ջ�ԭ��ǿ�������Ļ�ԭ��ǿ��ͭ�������������Ⱥ�����Ӧ�ٺ�ͭ��Ӧ��Fe+2Fe3+=3Fe2+��Cu+2Fe3+=Fe2++Cu2+����ʣ��Ĺ��������ͭ������������ͭ���Ӣ��������п��Եó���FeCl3��Һȫ�����뷴Ӧ������ֻ������һ����Ӧ�����ܽ��Fe������Ϊ11.2g��
13.2-1.28=11.92��11.2������ͬʱҲ��һ����Cu�ܽ⣨�����ڶ�����Ӧ��������ʣ��Ĺ���ȫ��ΪCu�����âڵ����ݸ��ݻ�ѧ����ʽ���м��㣬�������ͭ�����ʵ���֮�ȣ����â�������ݶԱ��ж�ʣ��Ĺ��壻������������ͭ�����ʵ���֮�ȼ�����鷴Ӧ����Һ�е�����������Ũ�ȣ�
��4������ʵ���������ݣ���Ϸ�Ӧ��ʵ�ʷ���������������ԭ��Ӧ�Ĺ��ɣ�������������ͭ���ܷ�Ӧ�����ջ�ԭ��ǿ�������Ļ�ԭ��ǿ��ͭ�������������Ⱥ�����Ӧ�ٺ�ͭ��Ӧ��Fe+2Fe3+=3Fe2+��Cu+2Fe3+=Fe2++Cu2+����ʣ��Ĺ��������ͭ������������ͭ���Ӣ��������п��Եó���FeCl3��Һȫ�����뷴Ӧ������ֻ������һ����Ӧ�����ܽ��Fe������Ϊ11.2g��
13.2-1.28=11.92��11.2������ͬʱҲ��һ����Cu�ܽ⣨�����ڶ�����Ӧ��������ʣ��Ĺ���ȫ��ΪCu�����âڵ����ݸ��ݻ�ѧ����ʽ���м��㣬�������ͭ�����ʵ���֮�ȣ����â�������ݶԱ��ж�ʣ��Ĺ��壻������������ͭ�����ʵ���֮�ȼ�����鷴Ӧ����Һ�е�����������Ũ�ȣ�
���
�⣺��֪M��R�����ֳ����Ľ������ʣ�����MΪ��ɫ���ж�MΪCu����EΪCu��NO3��2��QΪ��ɫ������˵��Y�к��������ӣ�E+R=M+X�����û���Ӧ��֤��RΪFe��XΪFe��NO3��2����X�м������ᣬ����Y����Fe3+������KOH������ZΪFe��OH��3���ɷ�Ӧ��֪����������ΪK2FeO4��
��1�������Ϸ�����֪RΪFe��λ�����ڱ��������ڢ��壬�ʴ�Ϊ���ģ�����
��2����Ӧ����ͭ�����ᷢ����������ԭ��Ӧ����Ӧ������������ͭ������������ԭ��Ӧ����Ӧ��������������������Һ�з�����������ԭ��Ӧ��������������Ӧ�������������������ط����ĸ��ֽⷴӦ����Ӧ���������Ӻ�����������ӽ�����������ӣ���Ӧ����������ԭ��Ӧ����Ӧ�������������ʹ��������������Ϊ����������ӣ�����������ԭ��Ӧ��
�ʴ�Ϊ���ܢݣ�
��3����Ӧ���Ǵ�����������ڼ�����Һ��������������Ϊ����������ӣ���Ӧ�����ӷ���ʽΪ��2Fe��OH��3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O��
�ʴ�Ϊ��2Fe��OH��3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O��
��4���Ӣ��������п��Եó���FeCl3��Һȫ�����뷴Ӧ������ֻ������һ����Ӧ�����ܽ��Fe������Ϊ11.2g��
13.2-1.28=11.92��11.2������ͬʱҲ��һ����Cu�ܽ⣨�����ڶ�����Ӧ��������ʣ��Ĺ���ȫ��ΪCu�����âڵ����ݣ���Cu��Fe�Ͻ��н������ʵ����ֱ�Ϊxmol��ymol��
Fe+2Fe3+=3Fe2+
x 0.2x
Cu+2Fe3+=Cu2++2Fe2+
0.2-x 0.4-0.2x
����ͭԪ���غ� ��0.2-x��+
=y�������غ� 56x+64y=13.2��������֮�ã�x=y=0.11
��ͭ�������ʵ�������1��1��
���飬6g�����к���Cu��Fe�����ʵ�����Ϊ0.05mol
Fe+2Fe3+=3Fe2+
0.05 0.1 0.15
Cu+2Fe3+=Cu2++2Fe2+
0.05 0.1 0.05 0.1
c��Fe3+��=
=2.0mol/L
�ʴ�Ϊ��1��1��2.0mol/L��
��1�������Ϸ�����֪RΪFe��λ�����ڱ��������ڢ��壬�ʴ�Ϊ���ģ�����
��2����Ӧ����ͭ�����ᷢ����������ԭ��Ӧ����Ӧ������������ͭ������������ԭ��Ӧ����Ӧ��������������������Һ�з�����������ԭ��Ӧ��������������Ӧ�������������������ط����ĸ��ֽⷴӦ����Ӧ���������Ӻ�����������ӽ�����������ӣ���Ӧ����������ԭ��Ӧ����Ӧ�������������ʹ��������������Ϊ����������ӣ�����������ԭ��Ӧ��
�ʴ�Ϊ���ܢݣ�
��3����Ӧ���Ǵ�����������ڼ�����Һ��������������Ϊ����������ӣ���Ӧ�����ӷ���ʽΪ��2Fe��OH��3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O��
�ʴ�Ϊ��2Fe��OH��3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O��
��4���Ӣ��������п��Եó���FeCl3��Һȫ�����뷴Ӧ������ֻ������һ����Ӧ�����ܽ��Fe������Ϊ11.2g��
13.2-1.28=11.92��11.2������ͬʱҲ��һ����Cu�ܽ⣨�����ڶ�����Ӧ��������ʣ��Ĺ���ȫ��ΪCu�����âڵ����ݣ���Cu��Fe�Ͻ��н������ʵ����ֱ�Ϊxmol��ymol��
Fe+2Fe3+=3Fe2+
x 0.2x
Cu+2Fe3+=Cu2++2Fe2+
0.2-x 0.4-0.2x
����ͭԪ���غ� ��0.2-x��+
| 1.28 |
| 64 |
��ͭ�������ʵ�������1��1��
���飬6g�����к���Cu��Fe�����ʵ�����Ϊ0.05mol
Fe+2Fe3+=3Fe2+
0.05 0.1 0.15
Cu+2Fe3+=Cu2++2Fe2+
0.05 0.1 0.05 0.1
c��Fe3+��=
| 0.4mol-0.2mol |
| 0.1L |
�ʴ�Ϊ��1��1��2.0mol/L��
���������⿼��������ƶϣ�Ϊ�߿��������ͣ�������ѧ���ķ��������Ŀ��飬ע������������ʺ�������������Ӧ�ã�������ԭ��Ӧ�ķ����жϣ����ӷ���ʽ��д���������ջ����ǽ���ؼ�����Ŀ�Ѷ��еȣ�

��ϰ��ϵ�д�
�����Ŀ
����ʵ������ܴﵽ��Ӧʵ��Ŀ���ǣ�������
| ѡ�� | A | B | C | D |
| ʵ��Ŀ�� | ʵ������ȡ���� | ��ͼʾ�ķ����ܼ���װ�õ������� | ֤����ķǽ����Աȹ�ǿ | ֤���ǽ�����Cl��C��Si |
| װ�ü�ҩƷ | 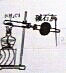 |  | 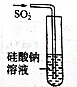 | 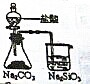 |
| A��A | B��B | C��C | D��D |
��ϵԪ�ص�ˮ���Ȼ���LnCl3?nH2O��������ˮʱ�����ֽ⣬Ϊ������ˮLnCl3���ɲ��õĴ�ʩ�ǣ�������
| A����HCl�����м���ʹ֮��ˮ |
| B����NH3�����м���ʹ֮��ˮ |
| C������P2O5�������ʹ֮��ˮ |
| D������H2SO4����ʹ֮��ˮ |
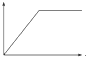
 ��1����ͼ��ij��Һϡ�����У���Һ�����ʵ���Ũ������Һ����ı仯����ͼ������ͼ�����ݷ����ó�a ֵ����
��1����ͼ��ij��Һϡ�����У���Һ�����ʵ���Ũ������Һ����ı仯����ͼ������ͼ�����ݷ����ó�a ֵ����