题目内容
如表是A、B、C、D四种有机物的有关信息,根据表中信息回答下列问题:
(1)写出在一定条件下,实验室制取A的化学方程式 ;
(2)A与氢气发生加成反应后生成E,与E分子组成和结构相似的同系物的通式均为CnH2n+2.当n= 时,该同系物开始有同分异构现象;
(3)B具有的性质是 (填序号):①不溶于水,②任何条件下不与氢气反应,③能与酸性KMnO4溶液反应,并使之褪色,④因发生取代反应而使溴水褪色;
(4)写出100℃时,在浓硫酸作用下,B与浓硝酸反应的化学方程式 ;
(5)C与D反应的反应类型为 ,反应方程式为: ;
(6)请书写符合下列条件所有可能有机物的结构简式 .
①与酯F互为同分异构体 ②在酸性条件下可以水解生成相对分子质量相同的两种物质.
| A | B | C | D |
| ①能使溴的四氯化碳溶液褪色 ②比例模型为 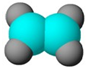 ③组成该有机物的两元素质量比为6:1 | ①由C、H两种元素组成 ②球棍模型为 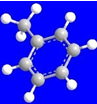 | ①由C、H、O三种元素组成 ②能与Na反应,但不能与NaOH溶液反应 ③能与D反应生成相对分子质量为130的酯F | ①由C、H、O三种元素组成 ②球棍模型为 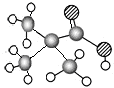 |
(2)A与氢气发生加成反应后生成E,与E分子组成和结构相似的同系物的通式均为CnH2n+2.当n=
(3)B具有的性质是
(4)写出100℃时,在浓硫酸作用下,B与浓硝酸反应的化学方程式
(5)C与D反应的反应类型为
(6)请书写符合下列条件所有可能有机物的结构简式
①与酯F互为同分异构体 ②在酸性条件下可以水解生成相对分子质量相同的两种物质.
考点:有机物的推断
专题:有机物的化学性质及推断
分析:A能使溴的四氯化碳溶液褪色,含有不饱和键,组成该有机物的两元素质量比为6:1,结合比例模型可知,A为CH2=CH2;B由C、H两种元素组成,由球棍模型模型,可知B为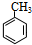 ;C由C、H、O三种元素组成,能与Na反应,但不能与NaOH溶液反应,含有羟基,能与D反应生成相对分子质量为130的酯F,则D属于羧酸,而D由C、H、O三种元素组成,结合D的球棍模型,可知D为(CH3)3C-COOH,结合F的相对分子质量可知,D只能为一元醇,则D的相对分子质量为130+18-102=46,可推知D为CH3CH2OH,F为(CH3)3C-COOCH2CH3,据此解答.
;C由C、H、O三种元素组成,能与Na反应,但不能与NaOH溶液反应,含有羟基,能与D反应生成相对分子质量为130的酯F,则D属于羧酸,而D由C、H、O三种元素组成,结合D的球棍模型,可知D为(CH3)3C-COOH,结合F的相对分子质量可知,D只能为一元醇,则D的相对分子质量为130+18-102=46,可推知D为CH3CH2OH,F为(CH3)3C-COOCH2CH3,据此解答.
 ;C由C、H、O三种元素组成,能与Na反应,但不能与NaOH溶液反应,含有羟基,能与D反应生成相对分子质量为130的酯F,则D属于羧酸,而D由C、H、O三种元素组成,结合D的球棍模型,可知D为(CH3)3C-COOH,结合F的相对分子质量可知,D只能为一元醇,则D的相对分子质量为130+18-102=46,可推知D为CH3CH2OH,F为(CH3)3C-COOCH2CH3,据此解答.
;C由C、H、O三种元素组成,能与Na反应,但不能与NaOH溶液反应,含有羟基,能与D反应生成相对分子质量为130的酯F,则D属于羧酸,而D由C、H、O三种元素组成,结合D的球棍模型,可知D为(CH3)3C-COOH,结合F的相对分子质量可知,D只能为一元醇,则D的相对分子质量为130+18-102=46,可推知D为CH3CH2OH,F为(CH3)3C-COOCH2CH3,据此解答.解答:
解:A能使溴的四氯化碳溶液褪色,含有不饱和键,组成该有机物的两元素质量比为6:1,结合比例模型可知,A为CH2=CH2;B由C、H两种元素组成,由球棍模型模型,可知B为 ;C由C、H、O三种元素组成,能与Na反应,但不能与NaOH溶液反应,含有羟基,能与D反应生成相对分子质量为130的酯F,则D属于羧酸,而D由C、H、O三种元素组成,结合D的球棍模型,可知D为(CH3)3C-COOH,结合F的相对分子质量可知,D只能为一元醇,则D的相对分子质量为130+18-102=46,可推知D为CH3CH2OH,F为(CH3)3C-COOCH2CH3,
;C由C、H、O三种元素组成,能与Na反应,但不能与NaOH溶液反应,含有羟基,能与D反应生成相对分子质量为130的酯F,则D属于羧酸,而D由C、H、O三种元素组成,结合D的球棍模型,可知D为(CH3)3C-COOH,结合F的相对分子质量可知,D只能为一元醇,则D的相对分子质量为130+18-102=46,可推知D为CH3CH2OH,F为(CH3)3C-COOCH2CH3,
(1)A为乙烯,实验室利用乙醇发生消去反应生成乙烯,反应方程式为:CH3CH2OH
CH2=CH2↑+H2O,
故答案为:CH3CH2OH
CH2=CH2↑+H2O;
(2)A与氢气发生加成反应后生成E为CH3CH3,与E分子组成和结构相似的同系物的通式均为CnH2n+2,当n=4时,该同系物开始有同分异构现象,故答案为:4;
(3)B为 ,属于烃类物质,不溶于水,含有苯环,能与氢气发生加成反应,含有甲基,能与酸性KMnO4溶液发生氧化反应,并使之褪色,不能与溴水发生取代反应而使溴水褪色,故答案为:①③;
,属于烃类物质,不溶于水,含有苯环,能与氢气发生加成反应,含有甲基,能与酸性KMnO4溶液发生氧化反应,并使之褪色,不能与溴水发生取代反应而使溴水褪色,故答案为:①③;
(4)100℃时,在浓硫酸作用下, 与浓硝酸反应的化学方程式为:
与浓硝酸反应的化学方程式为: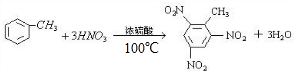 ,
,
故答案为: ;
;
(5)C与D是乙醇与(CH3)3C-COOH发生酯化反应生成(CH3)3C-COOCH2CH3,反应方程式为:CH3CH2OH+(CH3)3C-COOH
(CH3)3C-COOCH2CH3+H2O,也属于取代反应,
故答案为:CH3CH2OH+(CH3)3C-COOH
(CH3)3C-COOCH2CH3+H2O,酯化反应或取代反应;
(6)①与酯F互为同分异构体 ②在酸性条件下可以水解生成相对分子质量相同的两种物质,符合条件的同分异构体有:CH3CH2COOCH2CH2CH2CH3、CH3CH2COOCH2CH(CH3)2、CH3CH2COOCH(CH3) CH2CH3、CH3CH2COOC(CH3)3,
故答案为:CH3CH2COOCH2CH2CH2CH3、CH3CH2COOCH2CH(CH3)2、CH3CH2COOCH(CH3) CH2CH3、CH3CH2COOC(CH3)3.
 ;C由C、H、O三种元素组成,能与Na反应,但不能与NaOH溶液反应,含有羟基,能与D反应生成相对分子质量为130的酯F,则D属于羧酸,而D由C、H、O三种元素组成,结合D的球棍模型,可知D为(CH3)3C-COOH,结合F的相对分子质量可知,D只能为一元醇,则D的相对分子质量为130+18-102=46,可推知D为CH3CH2OH,F为(CH3)3C-COOCH2CH3,
;C由C、H、O三种元素组成,能与Na反应,但不能与NaOH溶液反应,含有羟基,能与D反应生成相对分子质量为130的酯F,则D属于羧酸,而D由C、H、O三种元素组成,结合D的球棍模型,可知D为(CH3)3C-COOH,结合F的相对分子质量可知,D只能为一元醇,则D的相对分子质量为130+18-102=46,可推知D为CH3CH2OH,F为(CH3)3C-COOCH2CH3,(1)A为乙烯,实验室利用乙醇发生消去反应生成乙烯,反应方程式为:CH3CH2OH
| 浓硫酸 |
| 170℃ |
故答案为:CH3CH2OH
| 浓硫酸 |
| 170℃ |
(2)A与氢气发生加成反应后生成E为CH3CH3,与E分子组成和结构相似的同系物的通式均为CnH2n+2,当n=4时,该同系物开始有同分异构现象,故答案为:4;
(3)B为
 ,属于烃类物质,不溶于水,含有苯环,能与氢气发生加成反应,含有甲基,能与酸性KMnO4溶液发生氧化反应,并使之褪色,不能与溴水发生取代反应而使溴水褪色,故答案为:①③;
,属于烃类物质,不溶于水,含有苯环,能与氢气发生加成反应,含有甲基,能与酸性KMnO4溶液发生氧化反应,并使之褪色,不能与溴水发生取代反应而使溴水褪色,故答案为:①③;(4)100℃时,在浓硫酸作用下,
 与浓硝酸反应的化学方程式为:
与浓硝酸反应的化学方程式为: ,
,故答案为:
 ;
;(5)C与D是乙醇与(CH3)3C-COOH发生酯化反应生成(CH3)3C-COOCH2CH3,反应方程式为:CH3CH2OH+(CH3)3C-COOH
| 浓硫酸 |
| △ |
故答案为:CH3CH2OH+(CH3)3C-COOH
| 浓硫酸 |
| △ |
(6)①与酯F互为同分异构体 ②在酸性条件下可以水解生成相对分子质量相同的两种物质,符合条件的同分异构体有:CH3CH2COOCH2CH2CH2CH3、CH3CH2COOCH2CH(CH3)2、CH3CH2COOCH(CH3) CH2CH3、CH3CH2COOC(CH3)3,
故答案为:CH3CH2COOCH2CH2CH2CH3、CH3CH2COOCH2CH(CH3)2、CH3CH2COOCH(CH3) CH2CH3、CH3CH2COOC(CH3)3.
点评:本题考查有机物推断、有机物结构与性质,注意利用结构模型进行推断,难度不大.

练习册系列答案
相关题目
下列几种试剂不能把等物质的量浓度的Na2CO3,NaHCO3鉴别开的是( )
| A、CaCl2溶液 |
| B、澄清石灰水 |
| C、稀盐酸 |
| D、pH试纸 |
R和Q为短周期中的两种元素,R元素原子的最外层电子数和次外层电子数之差的绝对值等于电子层数;Q元素的原子比R元素的原子多2个核外电子,则下列叙述中肯定错误的是( )
| A、原子半径:R>Q |
| B、R和Q可形成离子化合物 |
| C、R和Q可形成非极性分子RQ2 |
| D、R和Q可形成共价化合物RQ3 |
 纯碱是工业生产和日常生活中的重要物质.某兴趣小组为测定某工业纯碱(假设仅含碳酸氢钠杂质)中碳酸钠的质量分数,设计了下列四种实验方案进行探究.请填空:
纯碱是工业生产和日常生活中的重要物质.某兴趣小组为测定某工业纯碱(假设仅含碳酸氢钠杂质)中碳酸钠的质量分数,设计了下列四种实验方案进行探究.请填空:
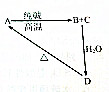 几种含硅物质的相互转化关系如图所示,其中物质A是一种高熔点化合物,不溶于稀硫酸、硝酸,却溶于氢氟酸;C是一种气体;D是白色胶状沉淀.
几种含硅物质的相互转化关系如图所示,其中物质A是一种高熔点化合物,不溶于稀硫酸、硝酸,却溶于氢氟酸;C是一种气体;D是白色胶状沉淀.