题目内容
7.下表为元素周期表的一部分,请回答有关问题:| IA | IIA | IIIA | IVA | VA | VIA | VIIA | O | |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 4 | ⑨ | ⑩ |
(2)表中能形成两性氢氧化物的元素是Al(填写元素符号),请写出该元素的氢氧化物与⑨的最高价氧化物对应水化物反应的化学方程式Al(OH)3+KOH=KAlO2+2H2O.
(3)元素⑥氢化物的化学式为H2S,其稳定性比H2O弱(填“强”或“弱”)
分析 根据元素在周期表中的位置知,①②③④⑤⑥⑦⑧⑨⑩分别是N、F、Mg、Al、Si、S、Cl、Ar、K、Br元素,
(1)⑤为硅元素;元素周期表中,最活泼的金属元素位于周期表左下角、最活泼的非金属元素位于周期表右上角,元素周期表中ⅠA族元素金属性较强;
(2)Al元素能形成两性氢氧化物氢氧化铝;⑨的最高价氧化物对应水化物为氢氧化钾,氢氧化铝与氢氧化钾溶液反应生成偏铝酸钾和水;
(3)⑥为S元素,氢化物为硫化氢;非金属性越强,氢化物稳定性越强.
解答 解:根据元素在周期表中的位置知,①②③④⑤⑥⑦⑧⑨⑩分别是N、F、Mg、Al、Si、S、Cl、Ar、K、Br元素,
(1)元素⑤位于周期表中第三周期ⅣA族,为硅元素;同一正确中ⅠA族最活泼,则十种元素中活泼性最强的元素为K,
故答案为:硅;K;
(2)Al元素能形成两性氢氧化物Al(OH)3,⑨最高价氧化物的水化物是KOH,Al(OH)3和与氢氧化钾反应的化学方程式为:Al(OH)3+KOH=KAlO2+2H2O,
故答案为:Al;Al(OH)3+KOH=KAlO2+2H2O;
(3)⑥为S元素,其氢化物为H2S,非金属性:O>S,则氢化物稳定性:H2O>H2S,即硫化氢的稳定性比水弱,
故答案为:H2S;弱.
点评 本题考查了位置结构与性质关系的应用,题目难度不大,明确元素周期表结构为解答关键,注意熟练掌握元素周期律内容,试题侧重基础知识的考查,培养了学生的灵活应用能力.

练习册系列答案
 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案
相关题目
6.某溶液中含有HCO3-,CO32-,SO32-,Na+,NO3-五种离子,若向其中加入足量的试剂Q,充分反应后溶被中有n种离子(不考虑水电离出的离子)的物质的量保持不变,下列有关Q、n的分析中错误的是( )
| 选项 | A | B | C | D |
| Q | Na2O2 | SO2 | BaCl2 | AlCl3 |
| n | 1 | 1 | 4 | 2 |
| A. | A | B. | B | C. | C | D. | D |
15.有关环境污染的下列说法中,不正确的是( )
| A. | 焚烧废旧塑料是减少“白色污染”的有效方法 | |
| B. | 二氧化硫是大气的主要污染物之一 | |
| C. | 氟氯烃能破坏大气臭氧层 | |
| D. | 从保护环境考虑,未来最理想的燃料是氢气 |
12.保护环境已成为人类的共识,人类应以可持续发展的方式使用资源,以合理的方式对废物进行处理并循环使用.下列做法不利于环境保护的是( )
| A. | 发电厂的煤经脱硫处理 | B. | 将煤转化为水煤气作燃料 | ||
| C. | 不使用塑料袋及一次性泡沫餐盒 | D. | 硫酸厂的废液经中和后直接排放 |
19.下列物质的性质比较,正确的是( )
| A. | 酸性:H2SO4<HClO | B. | 气态氢化物稳定性:HCl>H2S | ||
| C. | 离子半径:Na+>F- | D. | 碱性:NaOH>KOH |
16.锌粒和盐酸反应一段时间后,反应速率减慢.此时加热或加入浓盐酸,反应速率明显加快.上述实验中影响化学反应速率的因素有( )
①温度 ②固体的表面积 ③反应物的状态 ④溶液的浓度 ⑤催化剂.
①温度 ②固体的表面积 ③反应物的状态 ④溶液的浓度 ⑤催化剂.
| A. | ①④ | B. | ①③ | C. | ②④ | D. | ①②③④⑤ |
17.下列电离方程式正确的是( )
| A. | H2SO4?2H++SO42- | B. | H2CO3?2H++CO32- | ||
| C. | CH3COOH?H++CH3COO- | D. | NaHCO3=Na++H++CO32- |
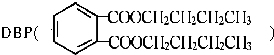 是一种常见的塑化剂,
是一种常见的塑化剂,
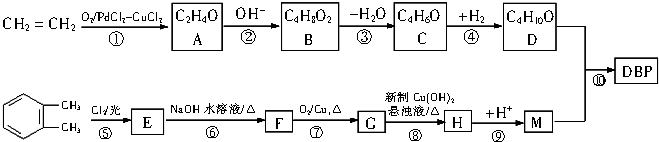
 .
. .
.
 .
.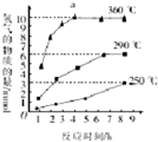 氧硫化碳(COS)可替代磷化氢而被用作熏蒸剂.
氧硫化碳(COS)可替代磷化氢而被用作熏蒸剂.