题目内容
19.下列物质的性质比较,正确的是( )| A. | 酸性:H2SO4<HClO | B. | 气态氢化物稳定性:HCl>H2S | ||
| C. | 离子半径:Na+>F- | D. | 碱性:NaOH>KOH |
分析 A.硫酸是强酸、HCl是弱酸;
B.元素的非金属性越强,其氢化物的稳定性越强;
C.电子层结构相同的离子,离子半径随着原子序数增大而减小;
D.元素的金属性越强,其最高价氧化物的水化物碱性越强.
解答 解:A.硫酸是强酸、HCl是弱酸,所以酸性:H2SO4>HClO,故A错误;
B.元素的非金属性越强,其氢化物的稳定性越强,非金属性Cl>S,所以气态氢化物稳定性:HCl>H2S,故B正确;
C.电子层结构相同的离子,离子半径随着原子序数增大而减小,这两种离子电子层结构相同,且原子序数Na>F,所以离子半径:Na+<F-,故C错误;
D.元素的金属性越强,其最高价氧化物的水化物碱性越强,金属性K>Na,所以碱性NaOH<KOH,故D错误;
故选B.
点评 本题考查元素周期律,为高频考点,明确同一主族、同一周期元素结构及性质递变规律是解本题关键,知道离子半径大小影响因素及比较方法,题目难度不大.

练习册系列答案
相关题目
10.已知:乙醇可被强氧化剂氧化为乙酸. 可经三步反应制取
可经三步反应制取  ,其中第二步的反应类型是( )
,其中第二步的反应类型是( )
 可经三步反应制取
可经三步反应制取  ,其中第二步的反应类型是( )
,其中第二步的反应类型是( )| A. | 水解反应 | B. | 加成反应 | C. | 消去反应 | D. | 氧化反应 |
7.下表为元素周期表的一部分,请回答有关问题:
(1)元素⑤的名称是硅,表中最活泼的金属是K(填写元素符号).
(2)表中能形成两性氢氧化物的元素是Al(填写元素符号),请写出该元素的氢氧化物与⑨的最高价氧化物对应水化物反应的化学方程式Al(OH)3+KOH=KAlO2+2H2O.
(3)元素⑥氢化物的化学式为H2S,其稳定性比H2O弱(填“强”或“弱”)
| IA | IIA | IIIA | IVA | VA | VIA | VIIA | O | |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 4 | ⑨ | ⑩ |
(2)表中能形成两性氢氧化物的元素是Al(填写元素符号),请写出该元素的氢氧化物与⑨的最高价氧化物对应水化物反应的化学方程式Al(OH)3+KOH=KAlO2+2H2O.
(3)元素⑥氢化物的化学式为H2S,其稳定性比H2O弱(填“强”或“弱”)
14.一定条件下,某反应达到平衡,其平衡常数为 K=$\frac{c(C{O}_{2})•c(NO)}{c(N{O}_{2})•c(CO)}$恒容时升高温度,混合气体的颜色加深,下列说法不正确的是( )
| A. | 该反应的焓变为负值 | |
| B. | 化学方程式为 NO2(g)+CO(g)?CO2(g)+NO(g) | |
| C. | 降温,正反应速率减小 | |
| D. | 恒温时,增大压强颜色加深,平衡逆向移动 |
4.已知甲、乙、丙、丁四种物有如下转化关系,其中甲、乙、丁均能发生银镜反应,则甲为( )


| A. | 甲醇 | B. | 甲醛 | C. | 乙酸 | D. | 乙醛 |
11.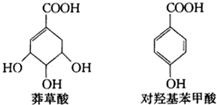 以莽草酸为原料,经多步反应可制取对羟基苯甲酸.莽草酸、对羟基苯甲酸的结构简式如图.下列说法正确的是( )
以莽草酸为原料,经多步反应可制取对羟基苯甲酸.莽草酸、对羟基苯甲酸的结构简式如图.下列说法正确的是( )
 以莽草酸为原料,经多步反应可制取对羟基苯甲酸.莽草酸、对羟基苯甲酸的结构简式如图.下列说法正确的是( )
以莽草酸为原料,经多步反应可制取对羟基苯甲酸.莽草酸、对羟基苯甲酸的结构简式如图.下列说法正确的是( )| A. | 莽草酸、对羟基苯甲酸都属于芳香族化合物 | |
| B. | 1mol莽草酸与NaOH溶液反应,最多消耗4 mol NaOH | |
| C. | 利用FeCl3溶液可鉴别莽草酸和对羟基苯甲酸 | |
| D. | 对羟基苯甲酸较稳定,在空气中不易被氧化 |
8.下列各组指定物质的同分异构体数目相等的是( )
| A. | 苯的二氯代物和苯的一硝基代物 | B. | C3H6Br2和C5H11Br | ||
| C. | 乙烷的二氯代物和丙烷的一氯代物 | D. | 丙烷的一氯代物和戊烷 |