题目内容
13.有以下物质:①铁红 ②Al ③C ④稀硫酸 ⑤浓硫酸 ⑥NaOH溶液⑦Al2(SO4)3(1)写出①与④反应的离子方程式Fe2O3+6H+=2Fe3++3H2O.
(2)既能跟④又能跟⑥反应的是②(填序号),写出它与⑥反应的化学方程式2Al+2NaOH+2H2O=2NaAlO2+3H2↑
(3)写出写出③与⑤在加热条件下反应的化学方程式C+2H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$2SO2↑+CO2↑+2H2O,下列关于该反应中⑤体现的性质说法正确的是b.
a.既体现氧化性又体现酸性 b.只体现氧化性 c.只体现酸性 d.体现吸水性
(4)34.2g⑦溶于水配成500mL溶液,溶液中SO42-的物质的量浓度为0.6mol/L.
分析 (1)①与④反应生成硫酸铁和水;
(2)上述物质中,既能跟④又能跟⑥反应的物质为Al,Al与NaOH溶液反应生成偏铝酸钠和氢气;
(3)③与⑤在加热条件下反应生成二氧化碳、二氧化硫和水,反应中S元素的化合价降低;
(4)结合n=$\frac{m}{M}$、c=$\frac{n}{V}$计算.
解答 解:(1)①与④反应生成硫酸铁和水,离子反应为Fe2O3+6H+=2Fe3++3H2O,故答案为:Fe2O3+6H+=2Fe3++3H2O;
(2)上述物质中,既能跟④又能跟⑥反应的物质为②Al,Al与NaOH溶液反应生成偏铝酸钠和氢气,反应为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,
故答案为:②;2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(3)③与⑤在加热条件下反应生成二氧化碳、二氧化硫和水,反应为C+2H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$2SO2↑+CO2↑+2H2O,反应中S元素的化合价降低,只体现氧化性,
故答案为:C+2H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$2SO2↑+CO2↑+2H2O;b;
(4)34.2g⑦溶于水配成500mL溶液,溶液中SO42-的物质的量浓度为$\frac{\frac{34.2g}{(27×2+96×3)g/mol}}{0.5L}$×3=0.6mol/L,故答案为:0.6mol/L.
点评 本题考查较综合,涉及离子反应、化学反应及物质的量的计算,为高频考点,把握发生的反应及物质的量的基本计算公式为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
19.下列有关实验操作或判断正确的是( )
| A. | 摩尔是化学上常用的一个物理量 | |
| B. | 用托盘天平称取25.20 gNaCl | |
| C. | 配制一定物质的量浓度的溶液,定容时俯视刻度线会导致所配溶液浓度偏小 | |
| D. | 某物质含有6.02×1023个微粒,含有这个数目微粒的物质不一定是1 mol |
1.今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现取三份100mL溶液进行如下实验:第一份加入AgNO3溶液有沉淀产生;第二份加足量NaOH溶液加热后,有刺激性气味的气体放出;第三份加足量BaCl2溶液后,得到白色沉淀,经足量盐酸洗涤,沉淀部分溶解.则下结论正确的是( )
| A. | 该混合液中一定含有:K+、NH4+、CO32-、SO42-,可能含Cl- | |
| B. | 该混合液中一定含有:NH4+、CO32-、SO42-,可能含K+、Cl- | |
| C. | 该混合液中一定含有:NH4+、CO32-、SO42-,可能含Mg2+、K+、Cl- | |
| D. | 该混合液中一定含有:NH4+、SO42-,可能含Mg2+、K+、Cl- |
8.下列溶液中,常温下可以用铁罐装运的是( )
| A. | 浓盐酸 | B. | 稀硫酸 | C. | 硫酸铜溶液 | D. | 浓硝酸 |
18.天津是我国研发和生产锂离子电池的重要基地.锂离子电池正极材料是含锂的二氧化钴(LiCoO2),充电时LiCoO2中Li 被氧化,Li+迁移并以原子形式嵌入电池负极材料碳(C6)中,以LiC6表示.电池反应为CoO2+LiC6 $?_{充电}^{放电}$LiCoO2+C6,下列说法正确的是( )
| A. | 充电时,电池的阳极反应为LiC6-e=Li++C6 | |
| B. | 放电时,电池的正极反应为 CoO2+Li++e-=LiCoO2 | |
| C. | 乙酸、乙醇等含活泼氢的有机物可做该锂离子电池的电解质 | |
| D. | 该锂离子电池的比能量(消耗单位质量电极所释放的电量)比铅蓄电池低 |
5.下列关于铜电极的叙述中不正确的是( )
| A. | 用电解法精炼粗铜时,粗铜作阳极 | |
| B. | 在原电池中,铜电极只能作正极 | |
| C. | 在镀件上镀铜时,金属铜作阳极 | |
| D. | 锌铜原电池(稀硫酸为电解质溶液),铜极上发生还原反应 |
2.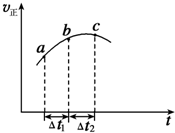 向绝热恒容密闭容器中通入SO2和NO2一定条件下使反应SO2(g)+NO2(g)
向绝热恒容密闭容器中通入SO2和NO2一定条件下使反应SO2(g)+NO2(g)
?SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如图所示,
由图可得出的不正确结论是( )
 向绝热恒容密闭容器中通入SO2和NO2一定条件下使反应SO2(g)+NO2(g)
向绝热恒容密闭容器中通入SO2和NO2一定条件下使反应SO2(g)+NO2(g)?SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如图所示,
由图可得出的不正确结论是( )
| A. | 反应在C点达到平衡状态 | |
| B. | 反应物的总能量大于生成物的总能量 | |
| C. | 反应物浓度:a点大于b点 | |
| D. | △t1=△t2时,SO2的转化率:a~b段小于b~c段 |
3.今有一混合物的水溶液,含有以下离子中的若干种:Na+、CO32-、Cl-、Ba2+、NH4+、SO42-,现取三份100mL该溶液进行如下实验:
(1)第一份加入AgNO3溶液有沉淀产生
(2)第二份加足量NaOH溶液,加热,收集到标准状况下的气体448mL(提示:NH4++OH-=NH3↑+H2O)
(3)第三份加足量Ba(NO3)2溶液,得沉淀4.30g,再用足量硝酸洗涤、干燥后,沉淀质量为2.33g.根据上述实验,下列推测不正确的是( )
(1)第一份加入AgNO3溶液有沉淀产生
(2)第二份加足量NaOH溶液,加热,收集到标准状况下的气体448mL(提示:NH4++OH-=NH3↑+H2O)
(3)第三份加足量Ba(NO3)2溶液,得沉淀4.30g,再用足量硝酸洗涤、干燥后,沉淀质量为2.33g.根据上述实验,下列推测不正确的是( )
| A. | 该溶液中.Na+一定存在,且浓度为0.1mol/L | |
| B. | 该溶液中CO32-和SO42-一定存在,且物质的量浓度均为0.1mol/L | |
| C. | Ba2+一定不存在 | |
| D. | NH4+ 一定存在,且100mL溶液中物质的量为0.02mol |