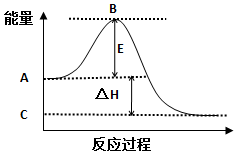
题目内容
16.“三酸两碱”是最重要的无机化工产品,广泛用于国防、石油、纺织、冶金、食品等工业.“三酸”是指硝酸、硫酸和盐酸,“两碱”指烧碱和纯碱.回答下列问题:
(1)写出过量稀硝酸分别与“两碱”溶液反应的离子方程式:H++OH-=H2O、2H++CO32-=H2O+CO2↑.
(2)请将“三酸两碱”中所含位于第三周期的元素,按原子半径由大到小的顺序排列Na>S>Cl.
(3)氯的非金属性比硫强(填“强”或“弱”),请用两个事实说明你的结论Cl2+H2S→S↓+2HCl;高氯酸的酸性比硫酸的酸性强(HCl的稳定性比H2S强).
(4)某烧碱溶液中含0.1molNaOH,向该溶液通入一定量CO2,充分反应后,将所得溶液低温蒸干,得到固体的组成可能有四种情况,分别是:
①NaOH和Na2CO3;②Na2CO3;③Na2CO3和NaHCO3;④NaHCO3.若该固体溶于水,滴加过量盐酸,再将溶液蒸干,得到固体的质量是5.85 g.
(5)将Na2CO3溶于水得到下列数据:
| 水 | Na2CO3 | 混合前温度 | 混合后温度 |
| 35mL | 3.2g | 20℃ | 24.3℃ |
分析 (1)硝酸可以和氢氧化钠之间反应生成硝酸钠、水;硝酸和碳酸钠之间反应生成硝酸钠、水以及二氧化碳;
(2)“三酸两碱”中所含位于第三周期的元素分别是Na、S、Cl,从左到右原子半径逐渐减小;
(3)比较非金属元素的非金属性强弱,可根据单质之间的置换反应、对应最高价氧化物的水化物的酸性、氢化物的稳定性等角度判断;
(4)0.1mol NaOH的溶液吸收一定量CO2后,根据吸收二氧化碳的量,溶液中溶质可能为:NaOH、Na2CO3或 Na2CO3或Na2CO3、NaHCO3或NaHCO3;
(5)Na2CO3滴入几滴水,生成Na2CO3•H2O晶体,为放热反应;结合表中数据判断实验前后温度的变化可得出结论.
解答 解:(1)硝酸可以和氢氧化钠之间反应生成硝酸钠、水;硝酸和碳酸钠之间反应生成硝酸钠、水以及二氧化碳;即离子方程式为:H++OH-=H2O,2H++CO32-=H2O+CO2↑,故答案为:H++OH-=H2O;2H++CO32-=H2O+CO2↑;
(2))“三酸两碱”中所含位于第三周期的元素分别是Na、S、Cl,从左到右原子半径逐渐减小,即原子半径大小顺序是:Na>S>Cl,
故答案为:Na>S>Cl;
(3)比较非金属元素的非金属性强弱,可根据单质之间的置换反应、对应最高价氧化物的水化物的酸性、氢化物的稳定性等角度判断,根据反应Cl2+H2S=S↓+2HCl、高氯酸的酸性比硫酸的酸性强、HCl的稳定性比H2S强等事实可以得到氯的非金属性比硫强,
故答案为:强;Cl2+H2S→S↓+2HCl、高氯酸的酸性比硫酸的酸性强(HCl的稳定性比H2S强);
(4)①0.1mol NaOH的溶液吸收一定量CO2后,根据吸收二氧化碳的量,当通入二氧化碳的量很少时,氢氧化钠过量,生成Na2CO3,故蒸干得到NaOH、Na2CO3;②当CO2与NaOH溶液恰好完全反应时,则生成a2CO3,低温蒸干得到Na2CO3;③当CO2稍过量时,会与部分Na2CO3反应生成NaHCO3,低温蒸干得到Na2CO3、NaHCO3;④当CO2大量过量时,Na2CO3完全转化为NaHCO3,低温蒸干得到NaHCO3,故溶液低温蒸干得到固体的组成为:NaOH、Na2CO3或 Na2CO3或Na2CO3、NaHCO3或NaHCO3,根据Na守恒,若该固体溶于水,滴加过量盐酸,再将溶液蒸干,得到固体氯化钠0.1mol,质量是5.85g;
故答案为:①NaOH和Na2CO3;③Na2CO3和NaHCO3;5.85;
(5)Na2CO3滴入几滴水,生成Na2CO3•H2O晶体,Na2CO3溶于水时,水合过程放出的热量大于扩散过程吸收的热量,即Na2CO3溶于水为放热反应;
故答案为:放;Na2CO3溶于水时,水合过程放出的热量大于扩散过程吸收的热量.
点评 本题涉及物质的分类、元素和化合物的性质、元素非金属性强弱比较等反方面的知识,属于综合知识的考查,难度不大.

| A. | 0.08 mol | B. | 0.16 mol | C. | 0.24 mol | D. | 0.32mol |
| A. | 过程的自发性只能用于判断过程的方向性,不能确定过程是否一定会发生和过程发生的速率 | |
| B. | 空气污染日报中的空气污染指数的主要项日有可吸入颗粒物、二氧化硫、二氧化氮 | |
| C. | 金属冶炼过程主要是利用金属矿物中的金属离子失去电子变成金属单质所发生的氧化还原反应 | |
| D. | 糖类和油脂是重要的基本营养物质,并且是人体所需能量的重要来源 |
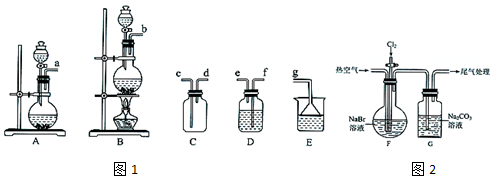
(l)用图1装置制备Cl2
①发生装置可选择图中的B,化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
②欲收集一瓶纯净干燥的Cl2,选择图中装置,其连接顺序为:发生装置→f→e→f→e→c→d→g(按气流方向,用小写字母表示,装置可重复使用).
(2)用下列装置模拟从海水中提溴.
对G中溶液继续如下实验(限选试剂:NaOH溶液、盐酸、稀H2SO4、CCI4)
已知:①3Br2+3CO32-═5Br-+BrO3-+3CO2:②Br2有强腐蚀性;③氧化性:BrO3->CI2.
| 操作步骤 | 实验现象 | 结论或解释 |
| ①去适量G中溶液于试管中,加入硫酸酸化 | 产生气泡 | G中溶液含有CO32-或HCO3- |
| 向①的试管中加入CCl4,振荡,静置 | ②溶液分层,下层为棕红色 | 生成单质溴 |
(3)工业上通常是将G中溶液运输到目的地后再酸化,主要是因为溴单质具有强腐蚀性.除去工业Br2中微量的Cl2,可向工业Br2中加入ac溶液.(填标号)
a.HBr b.Na2CO3 C.NaBr d.Na2SO3.
| A. | 放电时,NaTi2(PO4)3发生氧化反应 | |
| B. | 放电时,Na+向锌棒一极移动 | |
| C. | 充电时,阳极反应式为[Ti2(PO4)3]+-2e-=[Ti2(PO4)3]3+ | |
| D. | 充电时,每转移0.2 mol电子,阴极增重6.5 g |
| A. | 向稀硝酸中加入FeO:FeO+2H+═Fe2++H2O | |
| B. | 向Ca(HCO3)2溶液中加入过量NaOH溶液:Ca2++HCO3-+OH-═CaCO3↓+H2O | |
| C. | 向AgNO3溶液中加入过量的氨水:Ag++NH3•H2O═AgOH↓+NH4+ | |
| D. | 向热的稀硫酸中加入铜粉并鼓入空气:2Cu+4H++O2$\frac{\underline{\;\;△\;\;}}{\;}$2Cu2++2H2O |
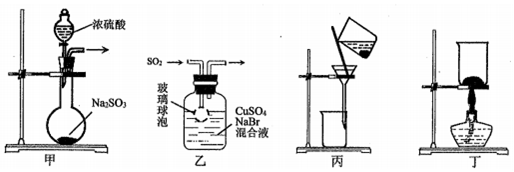
| A. | 用装置甲制取SO2 | B. | 用装置乙制取CuBr | ||
| C. | 用装置丙避光将CuBr与母液分离 | D. | 用装置丁干燥CuBr |
| A. | 在合成塔中加入3molH2与1molN2反应即可得到2molNH3 | |
| B. | 工业上合成SO3时可加入过量空气以提高SO2的转化率 | |
| C. | 利用Al、Mg、NaOH溶液、导线及电流计等可证明Al的金属活动性大于Mg的 | |
| D. | 冰箱保存的食品不易变质,与化学反应速率无关 |