题目内容
1.一种以2mol•L-1的Na2SO4溶液为电解质溶液的钠离子电池的总反应如下(P为+5价):NaTi2(PO4)3+Zn+Na2SO4$?_{充电}^{放电}$Na3Ti2(PO4)3+ZnSO4下列有关说法正确的是( )| A. | 放电时,NaTi2(PO4)3发生氧化反应 | |
| B. | 放电时,Na+向锌棒一极移动 | |
| C. | 充电时,阳极反应式为[Ti2(PO4)3]+-2e-=[Ti2(PO4)3]3+ | |
| D. | 充电时,每转移0.2 mol电子,阴极增重6.5 g |
分析 由反应总方程式可知,形成原电池时Zn元素化合价升高,被氧化,应为原电池负极反应,Ti元素化合价由+4价降低为+3价,为原电池正极反应,结合电极方程式解答该题.
解答 解:A.放电时,Ti元素化合价由+4价降低为+3价,则NaTi2(PO4)3发生还原反应,故A错误;
B.放电时,阳离子向正极移动,而锌为负极,故B错误;
C.充电时,阳极反应应为[Ti2(PO4)3]3--2e-=[Ti2(PO4)3]-,故C错误;
D.阴极发生Zn-2e-=Zn2+,充电时,每转移0.2 mol电子,生成0.1molZn,则增重6.5 g,故D正确.
故选D.
点评 本题考查化学电源新型电池,为高频考点,侧重考查学生的分析能力,明确元素化合价变化与电极名称关系是解本题关键,难点是电极反应式的书写,题目难度中等.

练习册系列答案
 名题金卷系列答案
名题金卷系列答案 优加精卷系列答案
优加精卷系列答案
相关题目
9.下列措施不利于环境保护的是( )
| A. | 推广使用风力发电 | B. | 提倡汽车燃油改燃气 | ||
| C. | 推广使用公共自行车 | D. | 提倡使用一次性木筷 |
16.“三酸两碱”是最重要的无机化工产品,广泛用于国防、石油、纺织、冶金、食品等工业.“三酸”是指硝酸、硫酸和盐酸,“两碱”指烧碱和纯碱.
回答下列问题:
(1)写出过量稀硝酸分别与“两碱”溶液反应的离子方程式:H++OH-=H2O、2H++CO32-=H2O+CO2↑.
(2)请将“三酸两碱”中所含位于第三周期的元素,按原子半径由大到小的顺序排列Na>S>Cl.
(3)氯的非金属性比硫强(填“强”或“弱”),请用两个事实说明你的结论Cl2+H2S→S↓+2HCl;高氯酸的酸性比硫酸的酸性强(HCl的稳定性比H2S强).
(4)某烧碱溶液中含0.1molNaOH,向该溶液通入一定量CO2,充分反应后,将所得溶液低温蒸干,得到固体的组成可能有四种情况,分别是:
①NaOH和Na2CO3;②Na2CO3;③Na2CO3和NaHCO3;④NaHCO3.若该固体溶于水,滴加过量盐酸,再将溶液蒸干,得到固体的质量是5.85 g.
(5)将Na2CO3溶于水得到下列数据:
Na2CO3溶于水放(填“吸”或“放”)热,请从溶解过程热效应的角度加以解释Na2CO3溶于水时,水合过程放出的热量大于扩散过程吸收的热量.
回答下列问题:
(1)写出过量稀硝酸分别与“两碱”溶液反应的离子方程式:H++OH-=H2O、2H++CO32-=H2O+CO2↑.
(2)请将“三酸两碱”中所含位于第三周期的元素,按原子半径由大到小的顺序排列Na>S>Cl.
(3)氯的非金属性比硫强(填“强”或“弱”),请用两个事实说明你的结论Cl2+H2S→S↓+2HCl;高氯酸的酸性比硫酸的酸性强(HCl的稳定性比H2S强).
(4)某烧碱溶液中含0.1molNaOH,向该溶液通入一定量CO2,充分反应后,将所得溶液低温蒸干,得到固体的组成可能有四种情况,分别是:
①NaOH和Na2CO3;②Na2CO3;③Na2CO3和NaHCO3;④NaHCO3.若该固体溶于水,滴加过量盐酸,再将溶液蒸干,得到固体的质量是5.85 g.
(5)将Na2CO3溶于水得到下列数据:
| 水 | Na2CO3 | 混合前温度 | 混合后温度 |
| 35mL | 3.2g | 20℃ | 24.3℃ |
6.下列有关化学用语表示正确的是( )
| A. | 乙烯的实验式:H2C═CH2 | B. | 四氯化碳的电子式: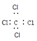 | ||
| C. | 含10个中子的氧原子:${\;}_{8}^{18}$O | D. | Al3+的结构示意图: |
13.化学与人类的生活息息相关,下列有关说法正确的是( )
| A. | 因铝表面能形成致密的氧化膜,所以铝制餐具可以长期使用 | |
| B. | 纤维的应用很广,人造纤维、合成纤维和光导纤维都是有机高分子化合物 | |
| C. | 新买的衣服先用水清洗,可除去衣服上残留的有防皱作用的甲醛整理剂 | |
| D. | 磨豆浆的大豆富含蛋白质,豆浆煮沸后蛋白质变成了氨基酸 |
10.为了研究外界条件对H2O2分解速率的影响,有同学利用实验室提供的仪器和试剂设计了如下4组实验.注意:设计实验时,必须控制只有一个变量!
试剂:4% H2O2溶液,12% H2O2溶液,lmol/LFeCl3溶液
仪器:试管、带刻度的胶头滴管、酒精灯
(1)甲同学为了研究温度对化学反应速率的影响,应完成1、2实验(填组别).
(2)乙同学进行实验3与实验4,发现气体均缓慢产生,无法说明“浓度改变会影响化学反应速率”,你的改进方法是再同时分别向试管甲和试管乙中滴加2~3滴lmol/LFeCl3溶液作为催化剂.
(3)丙同学进行了实验1与实验4,你认为他想探究的是探究催化剂对化学反应速率的影响.该方案设计是否严谨?否(填是或否),说明理由试管中加入1mL1mol/LFeCl3溶液会使H2O2溶液的浓度降低.
试剂:4% H2O2溶液,12% H2O2溶液,lmol/LFeCl3溶液
仪器:试管、带刻度的胶头滴管、酒精灯
| 组别 | 实验温度 (℃) | H2O2溶液 | FeCl3溶液 (1mol/L) |
| 1 | 30 | 5mL 4% | 1mL |
| 2 | 60 | 5mL 4% | 1mL |
| 3 | 30 | 5mL 12% | |
| 4 | 30 | 5mL 4% |
(2)乙同学进行实验3与实验4,发现气体均缓慢产生,无法说明“浓度改变会影响化学反应速率”,你的改进方法是再同时分别向试管甲和试管乙中滴加2~3滴lmol/LFeCl3溶液作为催化剂.
(3)丙同学进行了实验1与实验4,你认为他想探究的是探究催化剂对化学反应速率的影响.该方案设计是否严谨?否(填是或否),说明理由试管中加入1mL1mol/LFeCl3溶液会使H2O2溶液的浓度降低.
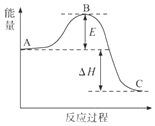 2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ•mol-1
2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ•mol-1 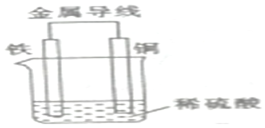 现有反应:①Ba(OH)2•8H2O+2NH4Cl═2NH3↑+BaCl2+10H2O,②Fe+H2SO4═FeSO4+H2↑.试回答下列问题:
现有反应:①Ba(OH)2•8H2O+2NH4Cl═2NH3↑+BaCl2+10H2O,②Fe+H2SO4═FeSO4+H2↑.试回答下列问题: