题目内容
7.2SO2(g)+O2(g)?2SO3(g)反应过程中的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ•mol-1.请回答下列问题: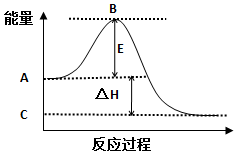
(1)图中A、C、E分别表示A反应物总能量、C生成物总能量、E活化能.
(2)图中△H=-198 kJ•mol-1.
(3)已知单质硫的燃烧热(△H)为-296kJ•mol-1,则S(s)生成3mol SO3(g)的△H=-1185kJ•mol-1.
分析 (1)A、C分别表示反应物总能量和生成物总能量,E表示为活化能;
(2)已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ•mol-1,故2molSO2(g)氧化为2mol SO3(g)的△H=-198kJ•mol-1,故△H=-198kJ•mol-1,据此进行分析;
(3)单质硫的燃烧热为296KJ•mol-1,所以热化学方程式为:S(s)+O2(g)═SO2(g)△H=-296kJ/mol,利用盖斯定理解答该题.
解答 解:(1)A、C分别表示反应物总能量和生成物总能量,E表示为活化能,
故答案为:反应物总能量;生成物总能量;活化能;
(2)已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ•mol-1,故2molSO2(g)氧化为2mol SO3(g)的△H=-198kJ•mol-1,故△H=-198kJ•mol-1,
故答案为:-198;
(3)因单质硫的燃烧热为296kJ•mol-1,则S(s)+O2(g)=SO2(g)△H=-296kJ•mol-1,
而 1mol SO2(g)氧化为1mol SO3的△H=-99kJ•mol-1,则SO2(g)+$\frac{1}{2}$O2(g)=SO3(g)△H=-99kJ•mol-1,
由盖斯定律可得:S(s)+$\frac{3}{2}$O2(g)=SO3(g)△H=-296kJ•mol-1+(-99kJ•mol-1)=-395kJ•mol-1,则S(s)生成1mol SO3(g)的△H=-395kJ•mol-1,故S(s)生成3mol SO3(g)的△H=-1185kJ•mol-1,
故答案为:-1185kJ•mol-1.
点评 本题综合考查反应热与焓变,为高考常见题型,侧重于学生的分析能力和计算能力的考查,注意反应热计算的应用,题目较简单.

| A. | 镁铝合金粉末着火后可用干冰灭火器灭火 | |
| B. | 自来水中的亚硝胺超标会危害人体健康 | |
| C. | 装潢涂料用苯作溶剂比用水作溶剂好 | |
| D. | 提倡使用一次性筷子、纸杯等,更有利于保护环境 |
| 选项 | 实验目的 | 实验操作 |
| A | 制备乙炔时,减缓乙炔的生成速率 | 用饱和食盐水替代水跟电石反应 |
| B | 证明NH4Cl溶液能促进Mg(OH)2固体的溶解 | 向两份等量的Mg(OH)2固体中分别加入等体积的蒸馏水和NH4Cl溶液 |
| C | 验证乙醇发生消去反应生成乙烯 | 将生成的气体直接通入含Br2的CCl4溶液中 |
| D | 证明Al2O3的熔点比Al高 | 把砂纸打磨过的铝箔在酒精灯上加热至熔化 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 化合物WY3中只含有离子键 | |
| B. | Y的简单气态氢化物的沸点比Z的低 | |
| C. | 原子半径:r(W)>r(Z)>r(Y)>r(X) | |
| D. | 由X、Z组成的化合物与由Z、W组成的化合物只能发生化合反应 |
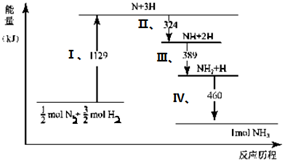
| A. | Ⅰ中1129 kJ为该反应过程的活化能 | |
| B. | N2(g)+3H2 (g)?2NH3 (g)△H=2(324+389+460-1129)kJ/mol | |
| C. | Ⅱ、Ⅲ、Ⅳ均为放热过程 | |
| D. | N2(g)+3H2 (g)?2NH3 (g)△H>0 |
回答下列问题:
(1)写出过量稀硝酸分别与“两碱”溶液反应的离子方程式:H++OH-=H2O、2H++CO32-=H2O+CO2↑.
(2)请将“三酸两碱”中所含位于第三周期的元素,按原子半径由大到小的顺序排列Na>S>Cl.
(3)氯的非金属性比硫强(填“强”或“弱”),请用两个事实说明你的结论Cl2+H2S→S↓+2HCl;高氯酸的酸性比硫酸的酸性强(HCl的稳定性比H2S强).
(4)某烧碱溶液中含0.1molNaOH,向该溶液通入一定量CO2,充分反应后,将所得溶液低温蒸干,得到固体的组成可能有四种情况,分别是:
①NaOH和Na2CO3;②Na2CO3;③Na2CO3和NaHCO3;④NaHCO3.若该固体溶于水,滴加过量盐酸,再将溶液蒸干,得到固体的质量是5.85 g.
(5)将Na2CO3溶于水得到下列数据:
| 水 | Na2CO3 | 混合前温度 | 混合后温度 |
| 35mL | 3.2g | 20℃ | 24.3℃ |
| 选项 | 实际应用 | 化学知识原理 |
| A | 选用金属锂做锂电池的负极 | 锂轻且在空气中稳定 |
| B | 工业采用高压(20-50MPa)合成NH3 | 应用勒夏特列原理 |
| C | 施加石膏降低盐碱地(含Na2CO3)的碱性 | CaCO3溶度积小于CaSO4 |
| D | 在船身上装锌块来避免船体遭受腐蚀 | Zn比Fe活泼 |
| A. | A | B. | B | C. | C | D. | D |
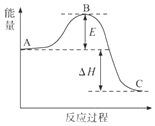 2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ•mol-1
2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ•mol-1