题目内容
11.某兴趣小组在实验室中模拟从海水中提澳.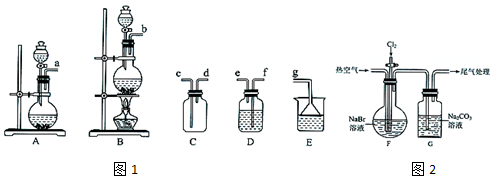
(l)用图1装置制备Cl2
①发生装置可选择图中的B,化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
②欲收集一瓶纯净干燥的Cl2,选择图中装置,其连接顺序为:发生装置→f→e→f→e→c→d→g(按气流方向,用小写字母表示,装置可重复使用).
(2)用下列装置模拟从海水中提溴.
对G中溶液继续如下实验(限选试剂:NaOH溶液、盐酸、稀H2SO4、CCI4)
已知:①3Br2+3CO32-═5Br-+BrO3-+3CO2:②Br2有强腐蚀性;③氧化性:BrO3->CI2.
| 操作步骤 | 实验现象 | 结论或解释 |
| ①去适量G中溶液于试管中,加入硫酸酸化 | 产生气泡 | G中溶液含有CO32-或HCO3- |
| 向①的试管中加入CCl4,振荡,静置 | ②溶液分层,下层为棕红色 | 生成单质溴 |
(3)工业上通常是将G中溶液运输到目的地后再酸化,主要是因为溴单质具有强腐蚀性.除去工业Br2中微量的Cl2,可向工业Br2中加入ac溶液.(填标号)
a.HBr b.Na2CO3 C.NaBr d.Na2SO3.
分析 (1)①实验室制备氯气是利用二氧化锰和浓盐酸加热反应生成;
②生成氯气含氯化氢和水蒸气,需要通过饱和食盐水除去氯化氢,通过浓硫酸除去水蒸气;
(2)对G中溶液为碳酸钠吸收溴单质的反应,3Br2+3CO32-═5Br-+BrO3-+3CO2,取适量G中溶液于试管中加入硫酸酸化,若生成气体证明G中溶液含有CO32-或HCO3-,同时发生反应生成溴单质,向①的试管中加入CCl4,振荡,静置会出现分层现象,下层四氯化碳层萃取溴单质呈棕红色;
(3)工业上通常是将G中溶液运输到目的地后再酸化生成溴单质,是因为溴单质具有强腐蚀性,除去工业Br2中微量的Cl2,能和氯气反应且不与溴单质反应.
解答 解:(1)①实验室制备氯气是利用二氧化锰和浓盐酸加热反应生成,选择装置B,反应的化学方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,
故答案为:B;MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
②生成氯气含氯化氢和水蒸气,需要通过饱和食盐水除去氯化氢,通过浓硫酸除去水蒸气,欲收集一瓶纯净干燥的Cl2,选择图中装置,其连接顺序为:发生装置b→f→e→f→e→c→d→g,
故答案为:f→e→f→e→c→d→g;
(2)对G中溶液为碳酸钠吸收溴单质的反应,3Br2+3CO32-═5Br-+BrO3-+3CO2,取适量G中溶液于试管中加入硫酸酸化,若生成气体证明G中溶液含有CO32-或HCO3-,同时发生反应生成溴单质,5Br-+BrO3-+6H+=3Br2+3H2O,向①的试管中加入CCl4,振荡,静置会出现分层现象,下层四氯化碳层萃取溴单质呈棕红色,
故答案为:硫酸酸化;溶液分层,下层为棕红色;5Br-+BrO3-+6H+=3Br2+3H2O;
(3)工业上通常是将G中溶液运输到目的地后再酸化,主要是因为溴单质具有强腐蚀性,除去工业Br2中微量的Cl2,可向工业Br2中加入a.HBr,C.NaBr,氯气发生反应生成溴单质,不引入杂质,b.Na2CO3,d.Na2SO3,和溴单质、氯气都发生反应,故不选,
故答案为:溴单质具有强腐蚀性;ac.
点评 本题考查了海水的资源利用和提取、物质性质分析判断、气体制备和除杂等,掌握基础是解题关键,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | Ba(HCO3)2、Al(NO3)3 | B. | CaCl2、NaHCO3 | C. | Al2(SO4)3、NaOH | D. | Na2CO3、CuSO4 |
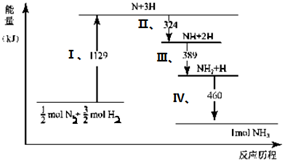
| A. | Ⅰ中1129 kJ为该反应过程的活化能 | |
| B. | N2(g)+3H2 (g)?2NH3 (g)△H=2(324+389+460-1129)kJ/mol | |
| C. | Ⅱ、Ⅲ、Ⅳ均为放热过程 | |
| D. | N2(g)+3H2 (g)?2NH3 (g)△H>0 |
| A. | 火山爆发产生的气体 | B. | 大气中二氧化碳含量增加 | ||
| C. | 乱砍乱伐森林,破坏了生态环境 | D. | 工业上大量燃烧含硫燃料 |
回答下列问题:
(1)写出过量稀硝酸分别与“两碱”溶液反应的离子方程式:H++OH-=H2O、2H++CO32-=H2O+CO2↑.
(2)请将“三酸两碱”中所含位于第三周期的元素,按原子半径由大到小的顺序排列Na>S>Cl.
(3)氯的非金属性比硫强(填“强”或“弱”),请用两个事实说明你的结论Cl2+H2S→S↓+2HCl;高氯酸的酸性比硫酸的酸性强(HCl的稳定性比H2S强).
(4)某烧碱溶液中含0.1molNaOH,向该溶液通入一定量CO2,充分反应后,将所得溶液低温蒸干,得到固体的组成可能有四种情况,分别是:
①NaOH和Na2CO3;②Na2CO3;③Na2CO3和NaHCO3;④NaHCO3.若该固体溶于水,滴加过量盐酸,再将溶液蒸干,得到固体的质量是5.85 g.
(5)将Na2CO3溶于水得到下列数据:
| 水 | Na2CO3 | 混合前温度 | 混合后温度 |
| 35mL | 3.2g | 20℃ | 24.3℃ |
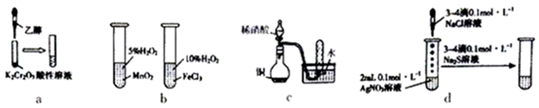
| A. | a图,滴加乙醇,试管中橙色溶液变为绿色,乙醇发生取代反应生成乙酸 | |
| B. | b图,左边试管中产生气泡迅速,说明二氧化锰的催化效果比氯化铁好 | |
| C. | c图,根据试管中收集到无色气体,能验证铜与稀硝酸的反应产物是NO | |
| D. | d图,试管中先有白色沉淀,后有黑色沉淀生成,能确定Ksp(AgCl)>Ksp(Ag2S) |
| A. | 乙酸的分子模型可表示为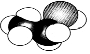 | |
| B. | 糖类、油脂、蛋自质都是高分子化合物 | |
| C. | 乙烯使溴的四氯化碳溶液褪色是因为发生了加成反应 | |
| D. | 炒菜时加酒和醋能使菜味香可口,原因是有酯类物质生成 |
| A. | 钙离子的结构示意图: | B. | 乙烯的结构简式:CH2CH2 | ||
| C. | CH4分子的球棍模型: | D. | 丙烯的电子式: |