题目内容
6.下列说法正确的是( )| A. | 在合成塔中加入3molH2与1molN2反应即可得到2molNH3 | |
| B. | 工业上合成SO3时可加入过量空气以提高SO2的转化率 | |
| C. | 利用Al、Mg、NaOH溶液、导线及电流计等可证明Al的金属活动性大于Mg的 | |
| D. | 冰箱保存的食品不易变质,与化学反应速率无关 |
分析 A.氮气和氢气的反应为可逆反应;
B.可加入过量空气,可使平衡正向移动;
C.比较金属性强弱,应根据金属与酸反应判断;
D.冰箱温度较低,可降低反应速率.
解答 解:A.氮气和氢气的反应为可逆反应,在合成塔中加入3molH2与1molN2反应,得到的NH3小于2mol,故A错误;
B.可加入过量空气,氧气浓度增多,则平衡正向移动,可提高SO2的转化率,故B正确;
C.铝与氢氧化钠溶液反应,而镁不反应,比较金属性强弱,应根据金属与酸反应判断,故C错误;
D.冰箱温度较低,可降低反应速率,可延长食品的变质时间,与速率有关,故D错误.
故选B.
点评 本题考查较为综合,涉及化学反应速率、平衡的影响以及可逆反应,金属性的比较等知识,为高频考点,侧重考查学生的分析能力,C为易错点,注意金属性的比较角度,难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
16.“三酸两碱”是最重要的无机化工产品,广泛用于国防、石油、纺织、冶金、食品等工业.“三酸”是指硝酸、硫酸和盐酸,“两碱”指烧碱和纯碱.
回答下列问题:
(1)写出过量稀硝酸分别与“两碱”溶液反应的离子方程式:H++OH-=H2O、2H++CO32-=H2O+CO2↑.
(2)请将“三酸两碱”中所含位于第三周期的元素,按原子半径由大到小的顺序排列Na>S>Cl.
(3)氯的非金属性比硫强(填“强”或“弱”),请用两个事实说明你的结论Cl2+H2S→S↓+2HCl;高氯酸的酸性比硫酸的酸性强(HCl的稳定性比H2S强).
(4)某烧碱溶液中含0.1molNaOH,向该溶液通入一定量CO2,充分反应后,将所得溶液低温蒸干,得到固体的组成可能有四种情况,分别是:
①NaOH和Na2CO3;②Na2CO3;③Na2CO3和NaHCO3;④NaHCO3.若该固体溶于水,滴加过量盐酸,再将溶液蒸干,得到固体的质量是5.85 g.
(5)将Na2CO3溶于水得到下列数据:
Na2CO3溶于水放(填“吸”或“放”)热,请从溶解过程热效应的角度加以解释Na2CO3溶于水时,水合过程放出的热量大于扩散过程吸收的热量.
回答下列问题:
(1)写出过量稀硝酸分别与“两碱”溶液反应的离子方程式:H++OH-=H2O、2H++CO32-=H2O+CO2↑.
(2)请将“三酸两碱”中所含位于第三周期的元素,按原子半径由大到小的顺序排列Na>S>Cl.
(3)氯的非金属性比硫强(填“强”或“弱”),请用两个事实说明你的结论Cl2+H2S→S↓+2HCl;高氯酸的酸性比硫酸的酸性强(HCl的稳定性比H2S强).
(4)某烧碱溶液中含0.1molNaOH,向该溶液通入一定量CO2,充分反应后,将所得溶液低温蒸干,得到固体的组成可能有四种情况,分别是:
①NaOH和Na2CO3;②Na2CO3;③Na2CO3和NaHCO3;④NaHCO3.若该固体溶于水,滴加过量盐酸,再将溶液蒸干,得到固体的质量是5.85 g.
(5)将Na2CO3溶于水得到下列数据:
| 水 | Na2CO3 | 混合前温度 | 混合后温度 |
| 35mL | 3.2g | 20℃ | 24.3℃ |
17.下列“化学知识原理”对“实际应用”的解释说明错误的是( )
| 选项 | 实际应用 | 化学知识原理 |
| A | 选用金属锂做锂电池的负极 | 锂轻且在空气中稳定 |
| B | 工业采用高压(20-50MPa)合成NH3 | 应用勒夏特列原理 |
| C | 施加石膏降低盐碱地(含Na2CO3)的碱性 | CaCO3溶度积小于CaSO4 |
| D | 在船身上装锌块来避免船体遭受腐蚀 | Zn比Fe活泼 |
| A. | A | B. | B | C. | C | D. | D |
14.下列变化过程中,需吸收能量的是( )
| A. | H+H→H2 | B. | I2→I+I | C. | 木炭燃烧 | D. | 铝与稀盐酸反应 |
1.下列有关化学用语不正确的是( )
| A. | 钙离子的结构示意图: | B. | 乙烯的结构简式:CH2CH2 | ||
| C. | CH4分子的球棍模型: | D. | 丙烯的电子式: |
18.下列图示与对应的叙述不相符合的是( )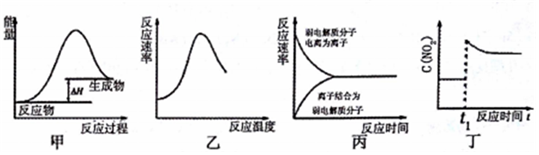

| A. | 图甲表示燃料燃烧反应的能量变化 | |
| B. | 图乙表示酶催化反应的反应速率随反应温度的变化 | |
| C. | 图丙表示弱电解质在水中建立电离平衡的过程 | |
| D. | 图丁表示平衡2NO2(g)?N2O4(g)在t1时迅速将体积缩小后c(NO2)的变化 |
15.下列说法中正确的是( )
| A. | 一切物质中都存在化学键 | |
| B. | 含有共价键的物质是共价化合物 | |
| C. | 由非金属元素组成的化合物是共价化合物 | |
| D. | 两个非金属元素原子间不可能形成离子键 |
11.一种以NaBH4和H2O2为原料的新型电池的工作原理如图所示.下列说法正确的是( )

| A. | 电子从电极a经电解质溶液流向电极b | |
| B. | 电池放电时Na+从b极区移向a极区 | |
| C. | 放电一段时间后,正极消耗的OH-和负极生成的OH-的量相等 | |
| D. | 电池的负极反应为BH4--8e-+8OH-=BO2+6H2O |
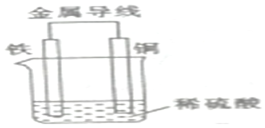 现有反应:①Ba(OH)2•8H2O+2NH4Cl═2NH3↑+BaCl2+10H2O,②Fe+H2SO4═FeSO4+H2↑.试回答下列问题:
现有反应:①Ba(OH)2•8H2O+2NH4Cl═2NH3↑+BaCl2+10H2O,②Fe+H2SO4═FeSO4+H2↑.试回答下列问题: