题目内容
9.25℃时,0.1mol/L HCl中,下列说法正确的是( )| A. | c(H+)×c(OH-)=1×10-14 | B. | 该溶液中由水电离出的c(H+)=1×10-7 | ||
| C. | c(H+)=c(OH-)=1×10-7 | D. | c(H+)×c(OH-)=1 |
分析 25℃时,水的离子积Kw=10-14,0.1mol/L HCl溶液中c(H+)=0.1mol/L,则c(OH-)=10-13mol/L,此溶液中的c(OH-)全部来自于水的电离,而溶液中水电离出的c(H+)恒等于水电离出的c(OH-),故水电离出的c(H+)10-13mol/L,据此分析.
解答 解:A、25℃时,水的离子积Kw=c(H+)•c(OH-)=10-14,只受温度的影响,与所处的溶液无关,故A正确;
B、在酸溶液中,氢离子几乎全部来自于酸的电离,而氢氧根全部来自于水的电离,而此溶液中c(OH-)=10-13mol/L,故水电离出的c(H+)10-13mol/L,故B错误;
C、此溶液显酸性,c(H+)=0.1mol/L,c(OH-)=10-13mol/L,两者不等,故C错误;
D、25℃时,水的离子积Kw=c(H+)•c(OH-)=10-14,故D错误.
故选A.
点评 本题考查了溶液中的离子浓度的计算和氢离子、氢氧根的来源问题,应注意的是在酸溶液中,氢离子几乎全部来自于酸的电离,而氢氧根全部来自于水的电离.

练习册系列答案
 名师指导一卷通系列答案
名师指导一卷通系列答案
相关题目
4.N2+3H2?2NH3合成氨反应中,在下列情况下,不能使反应速率加快的是( )
| A. | 充入氮气 | B. | 减小压强,扩大容器体积 | ||
| C. | 加入催化剂 | D. | 适当升高温度 |
1.M(NO3)2热分解化学方程式为:2M(NO3)2$\frac{\underline{\;\;△\;\;}}{\;}$2MO+4NO2↑+O2↑,加热59.2g M(NO3)2使其完全分解,在标准状况下收集22.4L的气体,那么M的摩尔质量是( )
| A. | 24g/mol | B. | 74g/mol | C. | 148g/mol | D. | 40g/mol |
18.A、B、C、D、E是原子序数依次增大的前四周期的常见元素.已知:
(1)写出E原子基态核外电子排布式1s22s22p63s23p63d104s1.比较B、C、D电负性的大小顺序C<N<O.(按由小到大)
(2)与C2互为等电子体的分子有CO,离子有CN-或C22-.
(3)E2+离子与氨基乙酸根离子(H2NCH2COO-)结合得到电中性的配合物(如图1),画出其中E2+离子与N、O原子间的化学键.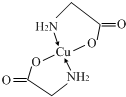 .
.
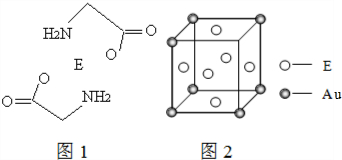
(4)E和金(Au)形成的合金的晶胞结构如图2,则该合金的化学式可表示为Cu3Au.
| A | 原子半径最小 |
| B | 核外3个能级上的电子数相等 |
| C | 其氢化物的沸点比同族相邻周期元素氢化物的沸点高 |
| D | 2p轨道上成对电子数与未成对电子数相等 |
| E | N层电子数为1,内层轨道全部排满电子 |
(2)与C2互为等电子体的分子有CO,离子有CN-或C22-.
(3)E2+离子与氨基乙酸根离子(H2NCH2COO-)结合得到电中性的配合物(如图1),画出其中E2+离子与N、O原子间的化学键.
 .
.(4)E和金(Au)形成的合金的晶胞结构如图2,则该合金的化学式可表示为Cu3Au.

19.下列叙述错误的是( )
| A. | 生铁中含有碳,抗腐蚀能力比纯铁弱 | |
| B. | 用锡焊接的铁质器件,焊接处易生锈 | |
| C. | 水库的钢闸门连电源正极不易被腐蚀 | |
| D. | 轮船船体镶嵌锌块,船体不易被腐蚀 |
 能源是人类生活和社会发展的基础,研究化学反应中的能量变化,有助于更好地利用化学反应为生产和生活服务.阅读下列有关能源的材料,回答有关问题:
能源是人类生活和社会发展的基础,研究化学反应中的能量变化,有助于更好地利用化学反应为生产和生活服务.阅读下列有关能源的材料,回答有关问题: .
. ,A2C的结构式:H-O-H.
,A2C的结构式:H-O-H. .
.