题目内容
1.M(NO3)2热分解化学方程式为:2M(NO3)2$\frac{\underline{\;\;△\;\;}}{\;}$2MO+4NO2↑+O2↑,加热59.2g M(NO3)2使其完全分解,在标准状况下收集22.4L的气体,那么M的摩尔质量是( )| A. | 24g/mol | B. | 74g/mol | C. | 148g/mol | D. | 40g/mol |
分析 根据标准状况下的气体摩尔体积计算出气体的物质的量,再根据反应方程式中化学计量数关系计算出59.2g M(NO3)2的物质的量,根据M=$\frac{m}{n}$计算出摩尔质量.
解答 解:在标准状况下收集气体体积为22.4L,物质的量为$\frac{22.4L}{22.4L/mol}$=1mol,
由反应可知氧气为1mol×$\frac{1}{1+4}$=0.2mol
根据反应方程式2M(NO3)2$\frac{\underline{\;\;△\;\;}}{\;}$2MO+4NO2↑+O2↑
0.4mol 0.2mol
M(NO3)2的摩尔质量为$\frac{59.2g}{0.4mol}$=148g/mol,
M的摩尔质量为148g/mol-62g/mol×2=24g/mol,
故选A.
点评 本题考查化学方程式的计算,为高频考点,把握物质的量计算公式及化学反应中的物质的量关系为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
11.一定条件下,下列反应中水蒸气含量随反应时间的变化趋势符合如图的是( )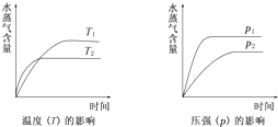

| A. | CH3CH2OH?CH2=CH2(g)+H2O(g);△H>0 | |
| B. | CO2(g)+H2(g)?CO(g)+H2O(g);△H>0 | |
| C. | CO2(g)+2NH3( g)?CO(NH2)2(s)+H2O(g);△H<0 | |
| D. | 2C6H5CH2CH3(g)+O2(g)?2C6H-5CH=CH2(g)+2H2O(g);△H<0 |
12.下列各组中的关系互为同系物的是( )
| A. | C2H6和C3H8 | B. | CH3-CH2-CH2-CH3和 | ||
| C. | 1H和2H | D. | O2和O3 |
9.25℃时,0.1mol/L HCl中,下列说法正确的是( )
| A. | c(H+)×c(OH-)=1×10-14 | B. | 该溶液中由水电离出的c(H+)=1×10-7 | ||
| C. | c(H+)=c(OH-)=1×10-7 | D. | c(H+)×c(OH-)=1 |
16.分别用一种试剂将下列物质中的少量杂质除去(括号内为混入的杂质).
| 物 质 | 需加入的试剂 | 有关离子方程式 |
| HNO3(HCl) | ||
| ZnSO4(CuSO4) | ||
| NaCl(Na2CO3) |
6.下列有关微粒表示正确且不影响水的电离的是( )
| A. | 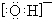 | B. | 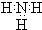 | C. | 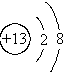 | D. | 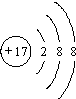 |
13.下列有关实验原理、方法或结论的描述正确的是( )
| A. | 配制FeSO4溶液时,需加入少量铁粉和稀盐酸,既防止氧化又抑制水解 | |
| B. | 向纯水中加入盐酸或降温都能使电离平衡逆向移动,但水的离子积不变 | |
| C. | 在滴有酚酞的Na2CO3溶液中,加入BaCl2溶液后红色褪去,验证Na2CO3溶液中存在水解平衡 | |
| D. | 已知I3-?I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫色,说明KI3在CCl4中的溶解度比在水中的大 |
10.如果你家里的食用花生油不小心混入了大量的水,利用你所学的知识,采用最简便的分离方法是( )
| A. | .蒸发 | B. | 分液 | C. | .蒸馏 | D. | 萃取 |
11.化学原理的利用对人类生产生活具有重要的作用.
(1)海洋资源的开发与利用具有广阔的前景.海水的pH一般在7.5~8.6之间.
某地海水中主要离子的含量如下表:
①海水显弱碱性的原因是(用离子方程式表示):HCO3-+H2O?H2CO3+OH-,
②工业上常用饱和食盐水为原料制备氯气,反应的化学反应方程式2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$ 2NaOH+Cl2↑+H2↑.
③电渗析法是近年发展起来的一种较好的海水淡化技术,其原理如图1所示.其中阴(阳)离子交换膜只允许阴(阳)离子通过.
a.电解一段时间,阴极区会产生水垢,其成分为CaCO3和Mg(OH)2,写出生成CaCO3的离子方程式:Ca2++OH-+HCO3-=CaCO3↓+H2O.
b.淡水的出口为a、b、c中的b出口.
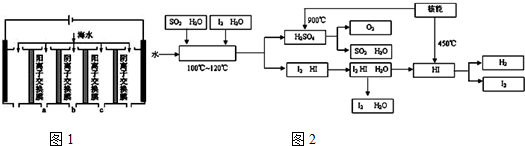
(2)科学家预测“氢能”将是未来最理想的新能源.
①实验测得,1g氢气燃烧生成液态水放出142.9kJ热量,则表示氢气燃烧热的热化学方程式为H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8 KJ/mol.
②如图2是某国正在研究中的一种流程(硫-碘热循环法制氢气),其中用了过量的碘.如图2方框中发生的化学反应方程式:SO2+I2+2H2O$\frac{\underline{\;100-120℃\;}}{\;}$2HI+H2SO4.
(1)海洋资源的开发与利用具有广阔的前景.海水的pH一般在7.5~8.6之间.
某地海水中主要离子的含量如下表:
| 成分 | Na+ | K+ | Ca2+ | Mg2+ | Cl- | SO42- | HCO3- |
| 含量/(mg•L-1) | 9360 | 83 | 200 | 1100 | 16000 | 1200 | 118 |
②工业上常用饱和食盐水为原料制备氯气,反应的化学反应方程式2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$ 2NaOH+Cl2↑+H2↑.
③电渗析法是近年发展起来的一种较好的海水淡化技术,其原理如图1所示.其中阴(阳)离子交换膜只允许阴(阳)离子通过.
a.电解一段时间,阴极区会产生水垢,其成分为CaCO3和Mg(OH)2,写出生成CaCO3的离子方程式:Ca2++OH-+HCO3-=CaCO3↓+H2O.
b.淡水的出口为a、b、c中的b出口.

(2)科学家预测“氢能”将是未来最理想的新能源.
①实验测得,1g氢气燃烧生成液态水放出142.9kJ热量,则表示氢气燃烧热的热化学方程式为H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8 KJ/mol.
②如图2是某国正在研究中的一种流程(硫-碘热循环法制氢气),其中用了过量的碘.如图2方框中发生的化学反应方程式:SO2+I2+2H2O$\frac{\underline{\;100-120℃\;}}{\;}$2HI+H2SO4.