题目内容
19.下列叙述错误的是( )| A. | 生铁中含有碳,抗腐蚀能力比纯铁弱 | |
| B. | 用锡焊接的铁质器件,焊接处易生锈 | |
| C. | 水库的钢闸门连电源正极不易被腐蚀 | |
| D. | 轮船船体镶嵌锌块,船体不易被腐蚀 |
分析 原电池中,作原电池负极的金属易失电子而被腐蚀,则作原电池正极的金属被保护,电镀时,镀层作电解池阳极,镀件作电解池阴极,含有与阳极相同元素的金属盐作电解质溶液,据此分析解答.
解答 解:A.生铁中含有碳,碳、铁和电解质溶液构成原电池,铁作负极而易被腐蚀,所以生铁的抗腐蚀能力比纯铁弱,故A正确;
B.锡、铁和电解质溶液构成原电池,铁作负极而易被腐蚀,所以用锡焊接的铁质器件,焊接处易生锈,故B正确;
C.在电解池中,当阳极是活性电极时,阳极易被腐蚀,故水库的钢闸门应连接电源的负极才不易被腐蚀,故C错误;
D.轮船上镶嵌锌块,锌、铁和电解质溶液构成原电池,铁作原电池正极而被保护,所以铁管不易被腐蚀,故D正确;
故选:C.
点评 本题考查了金属的腐蚀与防护,知道防止金属被腐蚀的电化学方法有:牺牲阳极的阴极保护法及外加电源的阴极保护法.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
9.25℃时,0.1mol/L HCl中,下列说法正确的是( )
| A. | c(H+)×c(OH-)=1×10-14 | B. | 该溶液中由水电离出的c(H+)=1×10-7 | ||
| C. | c(H+)=c(OH-)=1×10-7 | D. | c(H+)×c(OH-)=1 |
10.如果你家里的食用花生油不小心混入了大量的水,利用你所学的知识,采用最简便的分离方法是( )
| A. | .蒸发 | B. | 分液 | C. | .蒸馏 | D. | 萃取 |
7.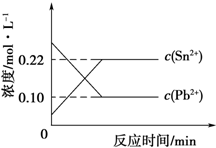 25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq)?Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示.下列判断不正确的是( )
25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq)?Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示.下列判断不正确的是( )
 25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq)?Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示.下列判断不正确的是( )
25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq)?Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示.下列判断不正确的是( )| A. | 25℃时,该反应的平衡常数K=2.2 | |
| B. | 往平衡体系中加入少量 Sn(NO3)2固体后,c(Pb2+)变大 | |
| C. | 往平衡体系中加入少量金属铅后,c(Pb2+)增大 | |
| D. | 升高温度,平衡体系中c(Pb2+)增大,说明该反应△H<0 |
4.下列应用元素周期律得到的推断中,正确的是( )
| A. | 铊(Tl)与铝同主族,其单质既能与盐酸反应,又能与氢氧化钠溶液反应 | |
| B. | 氟的非金属性比氯强,其最高价氧化物对应水化物的酸性比HClO4强 | |
| C. | 硒(Se)位于第四周期 VIA,其气态氢化物不如HCl稳定 | |
| D. | 第二周期非金属元素的气态氢化物溶于水后,水溶液均为酸性 |
11.化学原理的利用对人类生产生活具有重要的作用.
(1)海洋资源的开发与利用具有广阔的前景.海水的pH一般在7.5~8.6之间.
某地海水中主要离子的含量如下表:
①海水显弱碱性的原因是(用离子方程式表示):HCO3-+H2O?H2CO3+OH-,
②工业上常用饱和食盐水为原料制备氯气,反应的化学反应方程式2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$ 2NaOH+Cl2↑+H2↑.
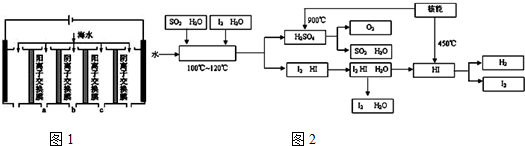
③电渗析法是近年发展起来的一种较好的海水淡化技术,其原理如图1所示.其中阴(阳)离子交换膜只允许阴(阳)离子通过.
a.电解一段时间,阴极区会产生水垢,其成分为CaCO3和Mg(OH)2,写出生成CaCO3的离子方程式:Ca2++OH-+HCO3-=CaCO3↓+H2O.
b.淡水的出口为a、b、c中的b出口.
(2)科学家预测“氢能”将是未来最理想的新能源.
①实验测得,1g氢气燃烧生成液态水放出142.9kJ热量,则表示氢气燃烧热的热化学方程式为H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8 KJ/mol.
②如图2是某国正在研究中的一种流程(硫-碘热循环法制氢气),其中用了过量的碘.如图2方框中发生的化学反应方程式:SO2+I2+2H2O$\frac{\underline{\;100-120℃\;}}{\;}$2HI+H2SO4.
(1)海洋资源的开发与利用具有广阔的前景.海水的pH一般在7.5~8.6之间.
某地海水中主要离子的含量如下表:
| 成分 | Na+ | K+ | Ca2+ | Mg2+ | Cl- | SO42- | HCO3- |
| 含量/(mg•L-1) | 9360 | 83 | 200 | 1100 | 16000 | 1200 | 118 |
②工业上常用饱和食盐水为原料制备氯气,反应的化学反应方程式2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$ 2NaOH+Cl2↑+H2↑.
③电渗析法是近年发展起来的一种较好的海水淡化技术,其原理如图1所示.其中阴(阳)离子交换膜只允许阴(阳)离子通过.
a.电解一段时间,阴极区会产生水垢,其成分为CaCO3和Mg(OH)2,写出生成CaCO3的离子方程式:Ca2++OH-+HCO3-=CaCO3↓+H2O.
b.淡水的出口为a、b、c中的b出口.

(2)科学家预测“氢能”将是未来最理想的新能源.
①实验测得,1g氢气燃烧生成液态水放出142.9kJ热量,则表示氢气燃烧热的热化学方程式为H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8 KJ/mol.
②如图2是某国正在研究中的一种流程(硫-碘热循环法制氢气),其中用了过量的碘.如图2方框中发生的化学反应方程式:SO2+I2+2H2O$\frac{\underline{\;100-120℃\;}}{\;}$2HI+H2SO4.
9.下列物质既是电解质又能导电的是( )
| A. | NaCl晶体 | B. | 液态HCl | C. | 熔融的KNO3 | D. | Na2SO4溶液 |
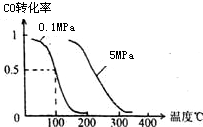 (1)在一定条件下,容积为 10L密闭容器中发生反应:CH4(g)+H2O(g)?CO(g)+3H2(g);△H>0
(1)在一定条件下,容积为 10L密闭容器中发生反应:CH4(g)+H2O(g)?CO(g)+3H2(g);△H>0 二氧化硫、一氧化碳、氮的氧化物、氨气都是非常重要的非金属化合物,研究这些化合物对环境保护、理解化学反应原理都具有重要意义.
二氧化硫、一氧化碳、氮的氧化物、氨气都是非常重要的非金属化合物,研究这些化合物对环境保护、理解化学反应原理都具有重要意义.