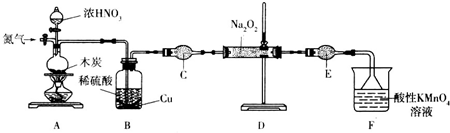
题目内容
10.下列物质既能与强酸反应,也能与强碱反应的是( )①Al ②Al2O3③Al(OH)3 ④NaHSO3⑤(NH4)2CO3⑥(CH3COO)2Cu⑦NH2-CH2-COOH.
| A. | ①②③⑦ | B. | 除⑤⑥外 | C. | ②③⑦ | D. | 全部 |
分析 Al、氧化铝、氢氧化铝、弱酸酸式盐、弱酸的铵盐、弱酸弱碱盐、氨基酸、蛋白质等物质都能和强酸、强碱溶液反应,据此分析解答.
解答 解:①Al能和强酸、强碱反应生成盐和氢气,故正确;
②Al2O3属于两性氧化物,能和强酸、强碱溶液反应生成盐和水,故正确;
③Al(OH)3 属于两性氢氧化物,能和强酸、强碱溶液反应生成盐和水,故正确;
④NaHSO3属于弱酸酸式盐,能和强酸、弱碱反应,故正确;
⑤(NH4)2CO3属于弱酸的铵盐,能和强酸、强碱溶液反应,故正确;
⑥(CH3COO)2Cu属于弱酸弱碱盐,能和强酸、强碱溶液反应,故正确;
⑦NH2-CH2-COOH属于氨基酸,能和强酸、强碱溶液反应,故正确;
故选D.
点评 本题考查元素化合物,为高频考点,明确元素化合物性质及物质之间的转化是解本题关键,注意氧化铝、氢氧化铝的两性,注意基础知识的积累,题目难度不大.

练习册系列答案
 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案 天天练口算系列答案
天天练口算系列答案
相关题目
1.已知等浓度的HF和NaF的混合溶液呈酸性,溶液中存在以下平衡:①HF?F-+H+;②F-+H2O?HF+OH-.常温下,向c(HF)+c(NaF)=0.1mol•L-1的溶液中分别加入以下物质,下列有关说法不正确的是( )
| A. | 加入少量Na2CO3固体,平衡①右移,平衡②左移,溶液中c(F-)增大 | |
| B. | 加入少量NaOH固体至c(F-)>c(HF),溶液一定呈碱性 | |
| C. | 加入少量Na至pH=8,则C(Na+)-c(F-)=0.99×10-7mol•L-1 | |
| D. | 加入少量盐酸,$\frac{c({F}^{-})}{c(HF)•c(O{H}^{-})}$不变 |
18.氮的氧化物(NOx)是大气污染物之一,工业上在一定温度和催化剂条件下用NH3将NOx还原生成N2.某同学在实验室中对NH3与NOx反应进行了探究:收集足量NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入NO2(两端用夹子K1、K2夹好).在一定温度下按图示装置进行实验.
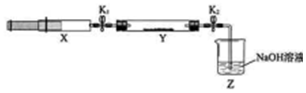

| 操作步骤 | 实验现象 | 解释原因 |
| 打开K1,推动注射器活塞,使X中的气体缓慢通入Y管中 | ①Y管中红棕色气体慢慢变浅 | ②反应的化学方程式 8NH3+6NO2 $\frac{\underline{\;催化剂\;}}{\;}$7N2+12H2O |
| 将注射器活塞退回原处并固定,待装置恢复到室温 | Y管中有少量水珠 | 生成的气态水凝集 |
| 打开K2 | ③Z中NaOH溶液产生倒吸现象 | ④反应后气体分子数减少,Y管中压强小于外压 |
5.锂电池反应原理如下:FePO4+Li$?_{充电}^{放电}$LiFePO4,内部为能够导电的固体电解质.下列有关该电池说法正确的是( )
| A. | 可加入硫酸以提高电解质的导电性 | |
| B. | 放电时电池内部Li+向负极移动 | |
| C. | 放电时,Li发生还原反应 | |
| D. | 放电时电池正极反应为:FePO4+e-+Li+═LiFePO4 |
2.下列有关双氧水跟酸性高锰酸钾反应的方程式正确的是( )
| A. | 2KMnO4+H2O2+3H2SO4═K2SO4+2MnSO4+3O2↑+4H2O | |
| B. | 2KMnO4+3H2O2+3H2SO4═K2SO4+2MnSO4+4O2↑+6H2O | |
| C. | 2KMnO4+5H2O2+3H2SO4═K2SO4+2MnSO4+5O2↑+8H2O | |
| D. | 8KMnO4+2H2O2+12H2SO4═4K2SO4+8MnSO4+11O2↑+14H2O |
11.滴定实验是化学学科中重要的定量实验.请回答下列问题:
(1)酸碱中和滴定--用标准盐酸滴定未知浓度的NaOH溶液.
①下列操作会造成测定结果偏高的是CD(填选项字母).
A.滴定终点读数时,俯视滴定管刻度,其他操作正确
B.盛NaOH溶液锥形瓶用蒸馏水洗后,未用NaOH溶液润洗
C.酸式滴定管用蒸馏水洗净后,未用标准盐酸润洗
D.滴定前,滴定管尖嘴有气泡,滴定后气泡消失
②某学生的实验操作如下:
A.用碱式滴定管取稀NaOH溶液25.00mL,注入锥形瓶中,加入甲基橙作指剂
B.用待测定的溶液润洗碱式滴定管
C.用蒸馏水洗干净滴定管
D.取下酸式滴定管,用标准HCl溶液润洗后,注入标准液至“0”刻度以 上2~3cm处,再把滴定管固定好,调节液面至“0”刻度或“0”刻度以下
E.检查滴定管是否漏水
F.另取锥形瓶,再重复操作一次
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度
a.滴定操作的正确顺序是(用序号填写)ECBADGF;
b.在G操作中如何确定滴定终点?当滴进最后一滴溶液由黄色变橙色,且半分钟内不变色.
(2)氧化还原滴定:取草酸溶液于锥形瓶中,加适量稀硫酸,用浓度为0.1mol•L-1的高锰酸钾溶液滴定,发生反应为:2KMnO4+5H2C2O4+3H2SO4═K2SO4+10CO2↑+22MnSO4+8H2O,表格记录了实验数据:
①滴定时,KMnO4溶液应装在酸(“酸”或“碱”)式滴定管中,达终点时的现象是锥形瓶中溶液由无色变为紫红色,且半分钟内不褪色.
②该草酸溶液的物质的量浓度为0.2mol/L.
(1)酸碱中和滴定--用标准盐酸滴定未知浓度的NaOH溶液.
①下列操作会造成测定结果偏高的是CD(填选项字母).
A.滴定终点读数时,俯视滴定管刻度,其他操作正确
B.盛NaOH溶液锥形瓶用蒸馏水洗后,未用NaOH溶液润洗
C.酸式滴定管用蒸馏水洗净后,未用标准盐酸润洗
D.滴定前,滴定管尖嘴有气泡,滴定后气泡消失
②某学生的实验操作如下:
A.用碱式滴定管取稀NaOH溶液25.00mL,注入锥形瓶中,加入甲基橙作指剂
B.用待测定的溶液润洗碱式滴定管
C.用蒸馏水洗干净滴定管
D.取下酸式滴定管,用标准HCl溶液润洗后,注入标准液至“0”刻度以 上2~3cm处,再把滴定管固定好,调节液面至“0”刻度或“0”刻度以下
E.检查滴定管是否漏水
F.另取锥形瓶,再重复操作一次
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度
a.滴定操作的正确顺序是(用序号填写)ECBADGF;
b.在G操作中如何确定滴定终点?当滴进最后一滴溶液由黄色变橙色,且半分钟内不变色.
(2)氧化还原滴定:取草酸溶液于锥形瓶中,加适量稀硫酸,用浓度为0.1mol•L-1的高锰酸钾溶液滴定,发生反应为:2KMnO4+5H2C2O4+3H2SO4═K2SO4+10CO2↑+22MnSO4+8H2O,表格记录了实验数据:
| 滴定次数 | 待测液体积 (mL) | 标准KMnO4溶液体积(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 25.00 | 0.50 | 20.40 |
| 第二次 | 25.00 | 3.00 | 23.00 |
| 第三次 | 25.00 | 4.00 | 24.10 |
②该草酸溶液的物质的量浓度为0.2mol/L.