题目内容
已知某可逆反应在密闭容器中进行:A(g)+2B(g)?3C(g)+D(g)(正反应为放热反应),图中曲线a代表一定条件下该反应的过程,若使曲线a变为b曲线,可采取的措施是( )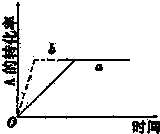

| A、增大A的浓度 |
| B、缩小容器的体积 |
| C、加入催化剂 |
| D、升高温度 |
考点:化学平衡的影响因素
专题:
分析:该反应是正反应气体体积增大的放热反应,使曲线a变为b曲线,加快了反应速率,没有影响平衡移动,据此分析.
解答:
解:该反应是正反应气体体积增大的放热反应,使曲线a变为b曲线,加快了反应速率,没有影响平衡移动,
A、增大A的浓度,平衡正向移动,故A错误;
B、酸性容器体积,平衡逆向移动,故B错误;
C、催化剂能够加快反应速率,平衡不移动,故C正确;
D、升温,平衡逆向移动,故D错误;
故选C.
A、增大A的浓度,平衡正向移动,故A错误;
B、酸性容器体积,平衡逆向移动,故B错误;
C、催化剂能够加快反应速率,平衡不移动,故C正确;
D、升温,平衡逆向移动,故D错误;
故选C.
点评:本题考查平衡图象、化学反应速率和化学平衡的影响因素等,难度中等.明确影响化学平衡移动的因素是解题的关键.

练习册系列答案
 互动英语系列答案
互动英语系列答案
相关题目
下列物质中属于电解质的是( )
| A、石墨 |
| B、CO2 |
| C、BaSO4 |
| D、Fe |
用下列实验装置完成对应的实验,能达到实验目的是( )
A、 用酒精从碘水中萃取碘 |
B、 收集H2或CO2 |
C、 从食盐水中提取NaCl |
D、 石油的分馏 |
要检验溴乙烷中的溴元素,下列实验方法正确的是( )
| A、加入新制的氯水振荡,再加入少量CCl4振荡,观察下层是否变为橙红色 |
| B、加入硝酸银溶液,再加入稀硝酸使溶液呈酸性,观察有无浅黄色沉淀生成 |
| C、加入NaOH溶液共热,冷却后加入硝酸银溶液,观察有无浅黄色沉淀生成 |
| D、加入NaOH溶液共热,冷却后加入稀硝酸使溶液呈酸性,再滴入硝酸银溶液,观察有无浅黄色沉淀生成 |
在恒温、恒容的条件下,有反应2A(气)+2B(气)?C(气)+3D(气),现从两条途径分别建立平衡
途径I:A、B的起始浓度分别为2mol/L
途径Ⅱ:C、D的起始浓度分别为2mol/L 和6mol/L;则以下叙述中正确的是( )
途径I:A、B的起始浓度分别为2mol/L
途径Ⅱ:C、D的起始浓度分别为2mol/L 和6mol/L;则以下叙述中正确的是( )
| A、两途径最终达到平衡时,体系内混合气体各组分百分组成相同 |
| B、两途径最终达到平衡时,体系内混合气体各组分百分组成不同 |
| C、达到平衡时,途径I的反应速率等于途径Ⅱ的反应速率 |
| D、达到平衡时,途径I所得混合气的密度等于途径Ⅱ所得混合气密度 |
有四种不同堆积方式的金属晶体的晶胞如图所示,有关说法正确的是( )
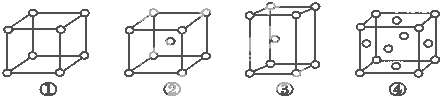

| A、①为简单立方堆积②为六方最密堆积③为体心立方堆积④为面心立方最密堆积 |
| B、每个晶胞含有的原子数分别为:①1个,②2个,③2个,④4个 |
| C、晶胞中原子的配位数分别为:①6,②8,③8,④12 |
| D、空间利用率的大小关系为:①<②<③<④ |
SCR法(选择性催化还原技术)是一种以NH3作为还原剂,将烟气中NOx分解成无害的N2和H2O的干法脱硝技术,反应原理为:①6NO+4NH3═5N2+6H2O;②6NO2+8NH3═7N2+12H2O;③NO+NO2+2NH3═2N2+3H2O.下列说法正确的是( )
| A、汽车尾气中含有NOx,NOx是引起温室效应的主要气体之一 |
| B、N2中π键与σ键之比为1:2 |
| C、反应③中每生成标况下的22.4 L N2转移电子数1.5NA |
| D、NH3的沸点比PH3的沸点高 |
 含有NaOH的Cu(OH)2悬浊液可用于检验醛基,也可用于和葡萄糖反应制备纳米Cu2O.
含有NaOH的Cu(OH)2悬浊液可用于检验醛基,也可用于和葡萄糖反应制备纳米Cu2O. ④HCHO等,
④HCHO等,