题目内容
 含有NaOH的Cu(OH)2悬浊液可用于检验醛基,也可用于和葡萄糖反应制备纳米Cu2O.
含有NaOH的Cu(OH)2悬浊液可用于检验醛基,也可用于和葡萄糖反应制备纳米Cu2O.(1)与OH-互为等电子体的一种分子为
(2)葡萄糖等很多不饱和有机物在Ni催化下可以与H2发生加成反应.如①CH2=CH2 ②CH≡CH③
 ④HCHO等,
④HCHO等,其中Ⅰ:①中含有的官能团名称是
Ⅱ:②中碳原子的轨道杂化类型是
(3)Cu属于
铜的另一种价态的离子Cu2+的水合离子中,提供孤电子对的原子是
(4)将氨气通入到Cu(OH)2悬浊液的离子方程式为
(5)Cu2O在稀硫酸中生成Cu和CuSO4,请写出该反应的化学方程式:
考点:原子核外电子排布,离子方程式的书写,“等电子原理”的应用,晶胞的计算,原子轨道杂化方式及杂化类型判断,铜金属及其重要化合物的主要性质
专题:
分析:(1)等电子体中原子个数相等、价电子个数相等,OH-中原子个数是2、价电子数是8;
(2)Ⅰ:①中含有的官能团名称是碳碳双键、③的分子式为C6H6;
Ⅱ:根据价层电子对互斥理论确定原子杂化方式、分子空间构型;
(3)根据原子最后排入电子名称确定元素所属区域;基态Cu+核外有28个电子,其3d电子为其价电子;
配合物中含有孤电子对的原子提供孤电子对、含有空轨道的原子提供空轨道;
(4)将氨气通入到Cu(OH)2悬浊液中生成铜氨络合物离子和氢氧根离子;
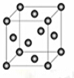
(5)Cu2O在稀硫酸中生成Cu和CuSO4,根据反应物和生成物书写方程式;铜晶体中每个铜原子周围等距离且最近的铜原子数目为3×8×
.
(2)Ⅰ:①中含有的官能团名称是碳碳双键、③的分子式为C6H6;
Ⅱ:根据价层电子对互斥理论确定原子杂化方式、分子空间构型;
(3)根据原子最后排入电子名称确定元素所属区域;基态Cu+核外有28个电子,其3d电子为其价电子;
配合物中含有孤电子对的原子提供孤电子对、含有空轨道的原子提供空轨道;
(4)将氨气通入到Cu(OH)2悬浊液中生成铜氨络合物离子和氢氧根离子;
(5)Cu2O在稀硫酸中生成Cu和CuSO4,根据反应物和生成物书写方程式;铜晶体中每个铜原子周围等距离且最近的铜原子数目为3×8×
| 1 |
| 2 |
解答:
解:(1)等电子体中原子个数相等、价电子个数相等,OH-中原子个数是2、价电子数是8,所以与OH-属于等电子体为HF,故答案为:HF;
(2)Ⅰ:①中含有的官能团名称是碳碳双键、③中每个C原子形成四个共价键,所以该物质的分子式为C6H6,故答案为:碳碳双键;C6H6;
II.②中C原子价层电子对个数是2且不含孤电子对,所以杂化方式为sp;④中C原子价层电子对个数是3且不含孤电子对,所以其空间构型为平面三角形,
故答案为:sp;平面三角形;
(3)Cu元素原子最后排入的电子是4s电子,其3d轨道排入电子,所以Cu元素属于ds区域,
基态Cu+核外有28个电子,其3d电子为其价电子,3d轨道上有10个电子,价电子排布式为3d10;
铜的另一种价态的离子Cu2+的水合离子中,提供孤电子对的原子是O原子、提供空轨道的原子是Cu,
故答案为:ds;3d10;O;
(4)将氨气通入到Cu(OH)2悬浊液中生成铜氨络合物离子和氢氧根离子,离子方程式为Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-,故答案为:Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-;
(5)Cu2O在稀硫酸中生成Cu和CuSO4,反应方程式为Cu2O+H2SO4=Cu SO4+Cu+H2O,铜晶体中每个铜原子周围等距离且最近的铜原子数目为3×8×
=12,故答案为:Cu2O+H2SO4=CuSO4+Cu+H2O;12.
(2)Ⅰ:①中含有的官能团名称是碳碳双键、③中每个C原子形成四个共价键,所以该物质的分子式为C6H6,故答案为:碳碳双键;C6H6;
II.②中C原子价层电子对个数是2且不含孤电子对,所以杂化方式为sp;④中C原子价层电子对个数是3且不含孤电子对,所以其空间构型为平面三角形,
故答案为:sp;平面三角形;
(3)Cu元素原子最后排入的电子是4s电子,其3d轨道排入电子,所以Cu元素属于ds区域,
基态Cu+核外有28个电子,其3d电子为其价电子,3d轨道上有10个电子,价电子排布式为3d10;
铜的另一种价态的离子Cu2+的水合离子中,提供孤电子对的原子是O原子、提供空轨道的原子是Cu,
故答案为:ds;3d10;O;
(4)将氨气通入到Cu(OH)2悬浊液中生成铜氨络合物离子和氢氧根离子,离子方程式为Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-,故答案为:Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-;
(5)Cu2O在稀硫酸中生成Cu和CuSO4,反应方程式为Cu2O+H2SO4=Cu SO4+Cu+H2O,铜晶体中每个铜原子周围等距离且最近的铜原子数目为3×8×
| 1 |
| 2 |
点评:本题考查物质结构和性质,涉及晶胞计算、原子杂化类型判断、核外电子排布、等电子体等知识点,综合性较强,侧重考查分析问题、计算、空间想象能力,难点是配位数的计算方法,题目难度中等.

练习册系列答案
相关题目
下列物质中属于纯净物、化合物、盐、钙盐的是( )
| A、CaO |
| B、Ca(OH) |
| C、CaCO3 |
| D、CH4 |
下列图示实验操作正确的是( )
A、 |
B、 |
C、 |
D、 |
 固定和利用CO2,能有效地利用资源,并减少空气中的温室气体.工业上正在研究利用CO2来生产甲醇燃料的方法,该方法的化学方程式是CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol,某科学实验将6mol CO2和8mol H2充入一容积为2L的密闭容器中,测得H2的物质的量随时间变化如图中实线所示(图中字母后数字表示对应的坐标):下列说法不正确的是( )
固定和利用CO2,能有效地利用资源,并减少空气中的温室气体.工业上正在研究利用CO2来生产甲醇燃料的方法,该方法的化学方程式是CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol,某科学实验将6mol CO2和8mol H2充入一容积为2L的密闭容器中,测得H2的物质的量随时间变化如图中实线所示(图中字母后数字表示对应的坐标):下列说法不正确的是( )| A、该反应在低温条件下能自发进行 |
| B、曲线Ⅰ改变的条件可能是升高温度 |
| C、若实线对应条件下平衡常数为K,曲线Ⅰ对应条件下平衡常数为K1,曲线Ⅱ对应条件下平衡常数为K2,则K、K1和K2的大小关系是:K2>K>K1 |
| D、容器内气体平均摩尔质量不再改变说明该反应达到平衡状态 |
已知某可逆反应在密闭容器中进行:A(g)+2B(g)?3C(g)+D(g)(正反应为放热反应),图中曲线a代表一定条件下该反应的过程,若使曲线a变为b曲线,可采取的措施是( )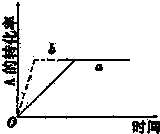

| A、增大A的浓度 |
| B、缩小容器的体积 |
| C、加入催化剂 |
| D、升高温度 |
下列实验操作中数据合理的是( )
| A、用10 mL 量筒量取5.2 mL盐酸 |
| B、用广泛pH试纸测得某溶液的pH值为12.5 |
| C、用托盘天平称取25.12gNaCl固体 |
| D、用100 mL容量瓶配制50mL0.1 mol/L的盐酸 |
将Mg、Al、Zn组成的混合物与足量的盐酸作用,放出H2的体积为2.8L(标准状况下),则这三种金属的物质的量之和可能为( )
| A、0.250 mol |
| B、0.125 mol |
| C、0.100 mol |
| D、0.080 mol |
 甲~丁是含同一种元素的四种物质,甲和丁分别是该元素的单质和最高价氧化物的水化物,它们之间有如图所示的转化关系,甲不可能是( )
甲~丁是含同一种元素的四种物质,甲和丁分别是该元素的单质和最高价氧化物的水化物,它们之间有如图所示的转化关系,甲不可能是( )| A、Fe | B、Si | C、Al | D、S |