题目内容
SCR法(选择性催化还原技术)是一种以NH3作为还原剂,将烟气中NOx分解成无害的N2和H2O的干法脱硝技术,反应原理为:①6NO+4NH3═5N2+6H2O;②6NO2+8NH3═7N2+12H2O;③NO+NO2+2NH3═2N2+3H2O.下列说法正确的是( )
| A、汽车尾气中含有NOx,NOx是引起温室效应的主要气体之一 |
| B、N2中π键与σ键之比为1:2 |
| C、反应③中每生成标况下的22.4 L N2转移电子数1.5NA |
| D、NH3的沸点比PH3的沸点高 |
考点:氮的氧化物的性质及其对环境的影响,氢键的存在对物质性质的影响,氧化还原反应
专题:
分析:A.NOX主要来自于汽车尾气的排放,温室效应是由于全球二氧化碳等气体的排放量不断增加,导致地球平均气温不断上升的现象;
B.共价单键是σ键,共价三键中含有2个π键1个σ键;
C.根据氮元素化合价的变化来分析;
D.利用相对分子质量分析分子间作用力,并注意氨气分子中有氢键.
B.共价单键是σ键,共价三键中含有2个π键1个σ键;
C.根据氮元素化合价的变化来分析;
D.利用相对分子质量分析分子间作用力,并注意氨气分子中有氢键.
解答:
解:A.NOx是汽车尾气中的主要污染物之一,二氧化碳是大气中的主要温室气体,故A错误;
B.N2中,存在N≡N,有1个σ键和2个π键,π键与σ键之比为2:1,故B错误;
C.N元素的化合价变化为NO中+2→0化合价降低,NO2中+4→0化合价降低,NH3中-3→0化合价升高,每生成22.4LN2,转移电子数3NA,故C错误;
D.因结构相似时,相对分子质量越大,分子间作用力越大,但氨气分子间还存在氢键,则NH3的沸点高于PH3,故D正确;
故选D.
B.N2中,存在N≡N,有1个σ键和2个π键,π键与σ键之比为2:1,故B错误;
C.N元素的化合价变化为NO中+2→0化合价降低,NO2中+4→0化合价降低,NH3中-3→0化合价升高,每生成22.4LN2,转移电子数3NA,故C错误;
D.因结构相似时,相对分子质量越大,分子间作用力越大,但氨气分子间还存在氢键,则NH3的沸点高于PH3,故D正确;
故选D.
点评:本题考查氮的氧化物、氮气、有关氮元素的氧化还原以及物质熔沸点的比较,侧重考查物质的结构与性质,明确氮气分子结构σ键和π键是解本题关键,题目难度中等.

练习册系列答案
相关题目
已知某可逆反应在密闭容器中进行:A(g)+2B(g)?3C(g)+D(g)(正反应为放热反应),图中曲线a代表一定条件下该反应的过程,若使曲线a变为b曲线,可采取的措施是( )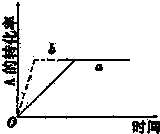

| A、增大A的浓度 |
| B、缩小容器的体积 |
| C、加入催化剂 |
| D、升高温度 |
下列烷烃在光照下与氯气反应,生成3种一氯代烃的是( )
| A、CH3CH2CH2CH3 |
| B、CH3CH(CH3)CH3 |
| C、(CH3)3CCH2CH3 |
| D、CH(CH3)2CH2CH3 |
化学与生产、生活、环境密切相关.下列说法错误的是( )
| A、航天飞机上的隔热陶瓷瓦属于复合材料 |
| B、水泥、陶瓷均为硅酸盐产品 |
| C、“光化学烟雾”、“硝酸型酸雨”的形成都与氮氧化物有关 |
| D、化学反应能够制造出新的物质,同时也能制造出新的元素 |
Mg-AgCl电池是一种能被海水激活的一次性贮备电池,其中某个电极的反应式为:AgCl?Ag-e-+Cl-.有关该电池的说法不正确的是( )
| A、AgCl发生了氧化反应 |
| B、可用于海上照明供电 |
| C、若将镁换成铝,也可构成海水原电池 |
| D、电子由镁电极流出 |
下列反应中,不属于氧化还原反应的是( )
| A、锌和硫酸反应:Zn+H2SO4═ZnSO4+H2 |
| B、碳酸钙和盐酸反应:CaCO3+2HCl═CaCl2+CO2+H2O |
| C、亚硫酸和双氧水反应:H2SO3+H2O2═H2SO4+H2O |
| D、铁和硫酸铜溶液反应:Fe+CuSO4═FeSO4+Cu |
下列离子反应方程式正确的是( )
| A、FeBr2中通入一定量Cl2:2Fe2++2Br-+2Cl2═4Cl-+Br2+2Fe3+ |
| B、少量SO2通入Ca(ClO)2溶液中:SO2+Ca2++2ClO-+H2O═CaSO3↓+2HClO |
| C、NaHCO3溶液中滴加NaOH溶液:HCO3-+OH-═H2O+CO2↑ |
| D、NaHSO4溶液中滴加Ba(OH)2溶液至中性:Ba2++OH-+H++SO42-═BaSO4↓+H2O |