题目内容
实验室用NaOH固体配制250mL 1.25mol/L的NaOH溶液,填空并请回答下列问题:
(1)配制250mL 1.25mol/L的NaOH溶液,应称取NaOH的质量 g;
(2)容量瓶上标有 ; 且使用前第一步操作是: ;
(3)溶液注入容量瓶前需冷却到室温,这是因为: ;
(4)定容时的操作: ;
(5)下列配制的溶液浓度偏低的是: ;
A.称量NaOH时,砝码错放在左盘
B.向容量瓶中转移溶液时不慎有液滴洒在容量瓶外面
C.定容时俯视刻度线
D.配制前,容量瓶中有少量蒸馏水
E.定容后经振荡、摇匀、正置,发现液面下降,再加适量的蒸馏水.
(1)配制250mL 1.25mol/L的NaOH溶液,应称取NaOH的质量
(2)容量瓶上标有
(3)溶液注入容量瓶前需冷却到室温,这是因为:
(4)定容时的操作:
(5)下列配制的溶液浓度偏低的是:
A.称量NaOH时,砝码错放在左盘
B.向容量瓶中转移溶液时不慎有液滴洒在容量瓶外面
C.定容时俯视刻度线
D.配制前,容量瓶中有少量蒸馏水
E.定容后经振荡、摇匀、正置,发现液面下降,再加适量的蒸馏水.
考点:溶液的配制
专题:实验题
分析:(1)根据n=cV和m=nM来计算;
(2)容量瓶上标有温度、容积和唯一一条刻度线;带塞子或活塞的仪器使用前必须检查是否漏水;
(3)根据氢氧化钠固体溶于水时放热来分析;
(4)根据定容时的操作来分析;
(5)根据c=
并结合溶质的物质的量n和溶液的体积V的变化来进行误差分析;
(2)容量瓶上标有温度、容积和唯一一条刻度线;带塞子或活塞的仪器使用前必须检查是否漏水;
(3)根据氢氧化钠固体溶于水时放热来分析;
(4)根据定容时的操作来分析;
(5)根据c=
| n |
| V |
解答:
解:(1)配制250mL 1.25mol/L的NaOH溶液,需要的NaOH的物质的量n=cV=1.25mol/L×0.25L=0.3125mol,需要的质量m=nM=0.3125mol×40g/mol=12.5g,故答案为:12.5;
(2)容量瓶上标有温度、容积和唯一一条刻度线;带塞子或活塞的仪器使用前必须检查是否漏水;故答案为:温度,容积,刻度线;检查是否漏水;
(3)氢氧化钠固体溶于水时放热,故溶液注入容量瓶前需冷却到室温,故答案为:NaOH溶于水时放热;
(4)定容时的操作是:向容量瓶中注入蒸馏水至离刻度线1-2cm处,改用胶头滴管逐滴滴加至凹液面最低点与刻度线刚好相切,故答案为:向容量瓶中注入蒸馏水至离刻度线1-2cm处,改用胶头滴管逐滴滴加至凹液面最低点与刻度线刚好相切;
(5)A.称量NaOH时,砝码错放在左盘时,m物=m砝-m游,故当砝码错放在左盘时会导致溶质的质量偏小,则浓度偏低,故有A选;
B.向容量瓶中转移溶液时不慎有液滴洒在容量瓶外面,会导致溶质的损失,则浓度偏低,故B不选;
C.定容时俯视刻度线,则溶液体积偏小,则浓度偏高,故C不选;
D.若容量瓶未干燥即用来配制溶液,对溶液浓度无影响,因为只要定容时正确,至于水是原来就有的还是后来加入的,对浓度无影响,故D不选;
E.定容后经振荡、摇匀、正置,发现液面下降是正常的,再加适量的蒸馏水会导致浓度偏低,故E选.
故选ABE.
(2)容量瓶上标有温度、容积和唯一一条刻度线;带塞子或活塞的仪器使用前必须检查是否漏水;故答案为:温度,容积,刻度线;检查是否漏水;
(3)氢氧化钠固体溶于水时放热,故溶液注入容量瓶前需冷却到室温,故答案为:NaOH溶于水时放热;
(4)定容时的操作是:向容量瓶中注入蒸馏水至离刻度线1-2cm处,改用胶头滴管逐滴滴加至凹液面最低点与刻度线刚好相切,故答案为:向容量瓶中注入蒸馏水至离刻度线1-2cm处,改用胶头滴管逐滴滴加至凹液面最低点与刻度线刚好相切;
(5)A.称量NaOH时,砝码错放在左盘时,m物=m砝-m游,故当砝码错放在左盘时会导致溶质的质量偏小,则浓度偏低,故有A选;
B.向容量瓶中转移溶液时不慎有液滴洒在容量瓶外面,会导致溶质的损失,则浓度偏低,故B不选;
C.定容时俯视刻度线,则溶液体积偏小,则浓度偏高,故C不选;
D.若容量瓶未干燥即用来配制溶液,对溶液浓度无影响,因为只要定容时正确,至于水是原来就有的还是后来加入的,对浓度无影响,故D不选;
E.定容后经振荡、摇匀、正置,发现液面下降是正常的,再加适量的蒸馏水会导致浓度偏低,故E选.
故选ABE.
点评:本题考查了一定物质的量浓度溶液的配制过程中的计算和误差分析,属于基础型题目,难度不大.

练习册系列答案
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案
相关题目
根据下列框图,下列说法正确的是( )
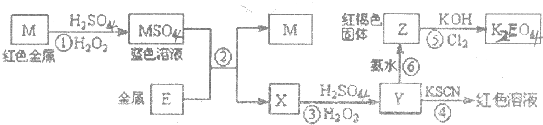

| A、M、E都是第四周期中的过渡元素,E的金属活动性比M的金属活动性强,E3+的氧化性比M2+的氧化性弱 |
| B、反应①、②、③、④、⑤都属于氧化还原反应,且在反应①和③中硫酸都是既表现了酸性、又表现了氧化性 |
| C、用K2EO4、Zn可制成一种高能电池,该电池中负极的电极反应式为:EO42-+4H2O+3e-═E(OH)3+5OH- |
| D、反应④、⑥的离子方程式分别可表示为E3++3SCN-=E(SCN)3,3NH3﹒H2O+E3+═E(OH)3↓+3NH4+ |
已知某可逆反应在密闭容器中进行:A(g)+2B(g)?3C(g)+D(g)(正反应为放热反应),图中曲线a代表一定条件下该反应的过程,若使曲线a变为b曲线,可采取的措施是( )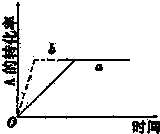

| A、增大A的浓度 |
| B、缩小容器的体积 |
| C、加入催化剂 |
| D、升高温度 |
将Mg、Al、Zn组成的混合物与足量的盐酸作用,放出H2的体积为2.8L(标准状况下),则这三种金属的物质的量之和可能为( )
| A、0.250 mol |
| B、0.125 mol |
| C、0.100 mol |
| D、0.080 mol |
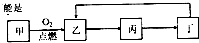 甲~丁是含同一种元素的四种物质,甲和丁分别是该元素的单质和最高价氧化物的水化物,它们之间有如图所示的转化关系,甲不可能是( )
甲~丁是含同一种元素的四种物质,甲和丁分别是该元素的单质和最高价氧化物的水化物,它们之间有如图所示的转化关系,甲不可能是( )| A、Fe | B、Si | C、Al | D、S |
下列烷烃在光照下与氯气反应,生成3种一氯代烃的是( )
| A、CH3CH2CH2CH3 |
| B、CH3CH(CH3)CH3 |
| C、(CH3)3CCH2CH3 |
| D、CH(CH3)2CH2CH3 |
下列反应中,不属于氧化还原反应的是( )
| A、锌和硫酸反应:Zn+H2SO4═ZnSO4+H2 |
| B、碳酸钙和盐酸反应:CaCO3+2HCl═CaCl2+CO2+H2O |
| C、亚硫酸和双氧水反应:H2SO3+H2O2═H2SO4+H2O |
| D、铁和硫酸铜溶液反应:Fe+CuSO4═FeSO4+Cu |