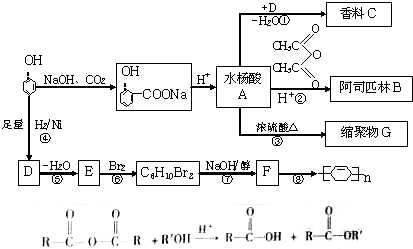
题目内容
 汽车尾气中的主要污染物是NO以及燃料不完全燃烧所产生的CO,它们是现代化城市中的大气污染物.为了减轻大气污染,人们提出通过以下反应来处理汽车尾气:2NO(g)+2CO(g)
汽车尾气中的主要污染物是NO以及燃料不完全燃烧所产生的CO,它们是现代化城市中的大气污染物.为了减轻大气污染,人们提出通过以下反应来处理汽车尾气:2NO(g)+2CO(g)| 催化剂 |
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/×10-4mol?L-1 | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
| c(CO)/×10-3mol?L-1 | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
(1)前3s内的平均反应速率v(N2)=
(2)假设在密闭容器中发生上述反应,达到平衡时改变下列条件,能提高NO转化率的是
A.选用更有效的催化剂 B.升高反应体系的温度 C.降低反应体系的温度 D.缩小容器的体积
(3)已知:N2(g)+O2(g)=2NO(g)△H1=+180.5kJ?mol-1
2C(s)+O2(g)=2CO(g)△H2=-221.0kJ?mol-1
C(s)+O2(g)=CO2(g)△H3=-393.5kJ?mol-1
则a=
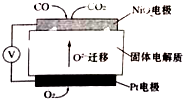
(4)科学家设计CO传感器用以监测CO的含量,其工作原理如图:则NiO电极上的电极反应式为
考点:化学平衡的计算,用盖斯定律进行有关反应热的计算,原电池和电解池的工作原理
专题:
分析:(1)计算出NO的反应速率,根据反应速率与化学计量数的关系可计算v(N2),计算出平衡时各物质的浓度,可计算平衡常数;
(2)能提高NO转化率,应使平衡向正向移动,结合温度、浓度等外界条件对平衡移动的影响解答;
(3)利用盖斯定律计算反应热;
(4)NiO电极上NO失电子和氧离子反应生成二氧化氮.
(2)能提高NO转化率,应使平衡向正向移动,结合温度、浓度等外界条件对平衡移动的影响解答;
(3)利用盖斯定律计算反应热;
(4)NiO电极上NO失电子和氧离子反应生成二氧化氮.
解答:
解:(1)前3s内的平均反应速率v(N2)=
v(N0)=
×
=1.42×10-4 mol?L-1?S-1,
由表格中的数据可知到4s时达到化学平衡,则
2NO+2CO
2CO2+N2,
开始1.00×10-3 3.60×10-3 0 0
转化9×10-4 9×10-4 9×10-4 4.50×10-4
平衡1.00×10-4 2.70×10-3 9×10-4 4.50×10-4
则 K=
=5000,
故答案为:1.42×10-4 mol?L-1?S-1;5000;
(2)A.选用更有效的催化剂,不能使平衡发生移动,故A错误;
B.升高反应体系的温度,因反应放热,则平衡逆向移动,转化率减小,故B错误;
C.降低反应体系的温度,平衡正向移动,转化率增大,故C正确;
D.缩小容器的体积,平衡正向移动,转化率增大,故D正确,
故答案为:CD;
(3)已知:①N2(g)+O2(g)=2NO(g)△H1=+180.5kJ?mol-1
②2C(s)+O2(g)=2CO(g)△H2=-221.0kJ?mol-1
③C(s)+O2(g)=CO2(g)△H3=-393.5kJ?mol-1,
将③×2-①-②可得2NO(g)+2CO(g)
2CO2(g)+N2(g)△H=2×(-393.5kJ?mol-1)-(-221.0kJ?mol-1)-(+180.5kJ?mol-1)=-746.5kJ?mol-1,
故答案为:-746.5;
(4)铂电极上NiO电极上CO失电子和氧离子反应生成二氧化碳,所以电极反应式为CO+O2--2e-=CO2,
故答案为:CO-2e-+O2-=CO2.
| 1 |
| 2 |
| 1 |
| 2 |
| 10.0×10 -4mol/L-1.50×10 -4mol/L |
| 3s |
由表格中的数据可知到4s时达到化学平衡,则
2NO+2CO
| ||
开始1.00×10-3 3.60×10-3 0 0
转化9×10-4 9×10-4 9×10-4 4.50×10-4
平衡1.00×10-4 2.70×10-3 9×10-4 4.50×10-4
则 K=
| (4.50×10 -4)?(9×10 -4)2 |
| (1.00×10 -4)?(2.7×10 -3)2 |
故答案为:1.42×10-4 mol?L-1?S-1;5000;
(2)A.选用更有效的催化剂,不能使平衡发生移动,故A错误;
B.升高反应体系的温度,因反应放热,则平衡逆向移动,转化率减小,故B错误;
C.降低反应体系的温度,平衡正向移动,转化率增大,故C正确;
D.缩小容器的体积,平衡正向移动,转化率增大,故D正确,
故答案为:CD;
(3)已知:①N2(g)+O2(g)=2NO(g)△H1=+180.5kJ?mol-1
②2C(s)+O2(g)=2CO(g)△H2=-221.0kJ?mol-1
③C(s)+O2(g)=CO2(g)△H3=-393.5kJ?mol-1,
将③×2-①-②可得2NO(g)+2CO(g)
| ||
故答案为:-746.5;
(4)铂电极上NiO电极上CO失电子和氧离子反应生成二氧化碳,所以电极反应式为CO+O2--2e-=CO2,
故答案为:CO-2e-+O2-=CO2.
点评:本题考查较为综合,涉及盖斯定律的应用、平衡移动的影响以及电极反应式的书写,侧重于学生的分析能力、计算能力的考查,为高考常见题型,难度较大.

练习册系列答案
 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案
相关题目
下列叙述正确的是( )
| A、同温同压下,相同体积的物质,其物质的量一定相等 |
| B、任何条件下,等物质的量的甲烷和一氧化碳所含的分子数一定相等 |
| C、1 L一氧化碳气体一定比1 L氧气的质量小 |
| D、相同条件下的一氧化碳气体和氮气,若物质的量相等则体积相等,但质量不相等 |
设NA为阿伏加德岁常数,下列叙述正确的是( )
| A、1L 0.1 mol?L-1碳酸钠溶液中的阴离子总数为0.1NA |
| B、将400 mL 1 mol/L的HNO3溶液与7 g Fe粉充分反应,转移电子数为0.375NA |
| C、标准状况下,14 g氮气中共用电子对的数目为1.5NA |
| D、已知反应N2(g)+3H2(g)?2NH3(g)△H=-91.8KJ/mol中反应物的转化率为30%,相同条件下,当放出91.8 kJ热量时,生成氨分子的数目为0.6NA |
按如图所示装置进行实验,将液体A逐滴加入到固体B中,下列叙述正确的是( )
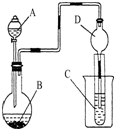

| A、若A为浓盐酸,B为MnO2,C中盛品红溶液,则C中溶液褪色 |
| B、若A为醋酸,B为贝壳,C中盛澄清石灰水,则C中溶液变浑浊 |
| C、实验仪器D主要起到洗气的作用 |
| D、若A为浓氨水,B为生石灰,C中AlCl3溶液,则C中先产生白色沉淀后沉淀又溶解 |