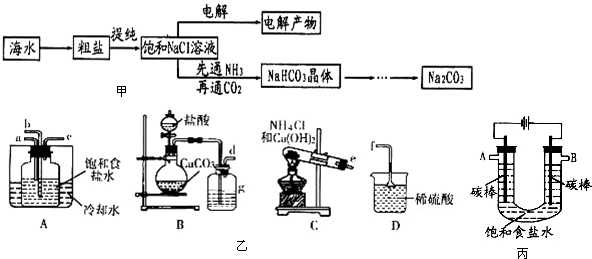
题目内容
通过下列两步实验测定草酸晶体(H2C2O4?xH2O)中结晶水x的值:
(1)称取mg草酸晶体,配制成100.0mL溶液.
(2)取25.0mL所配溶液置于锥形瓶中,加入适量稀硫酸后,用浓度为a mol?L-1 KMnO4溶液进行滴定.
其反应原理是:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O
请回答下列问题:
①实验(2)中,KMnO4应装在 滴定管中(填“酸式”、“碱式”),滴定前是否需要在锥形瓶内加入指示剂 (填“是”、“否”),原因是 ;
②若滴定用的KMnO4溶液因放置时间过长而部分变质,浓度偏低,则根据实验求出的x值 (填“偏高”、“偏低”、“无影响”);
③若滴定终点时,共用去KMnO4溶液VmL,则草酸溶液浓度为 mol?L-1,x= (用含有m、V的代数式表示)
(1)称取mg草酸晶体,配制成100.0mL溶液.
(2)取25.0mL所配溶液置于锥形瓶中,加入适量稀硫酸后,用浓度为a mol?L-1 KMnO4溶液进行滴定.
其反应原理是:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O
请回答下列问题:
①实验(2)中,KMnO4应装在
②若滴定用的KMnO4溶液因放置时间过长而部分变质,浓度偏低,则根据实验求出的x值
③若滴定终点时,共用去KMnO4溶液VmL,则草酸溶液浓度为
考点:硫酸铜晶体中结晶水含量的测定
专题:实验设计题
分析:①(2)KMnO4溶液具有强氧化性,可以腐蚀橡皮管,故KMnO4溶液应装在酸式滴定管中;
KMnO4溶液呈紫色,草酸反应完毕,滴入最后一滴KMnO4溶液,紫色不褪去,说明滴定到终点,不需要外加指示剂;
②由题给化学方程式及数据可得出X,若滴定用的KMnO4溶液因放置时间过长而部分变质,浓度偏低,则所得消耗酸性KMnO4溶液的体积偏大,由此所得n(H2C2O4)偏大,则n(H2O)偏小,x偏低;
③根据化学方程式及各物质之间的关系进行计算.
KMnO4溶液呈紫色,草酸反应完毕,滴入最后一滴KMnO4溶液,紫色不褪去,说明滴定到终点,不需要外加指示剂;
②由题给化学方程式及数据可得出X,若滴定用的KMnO4溶液因放置时间过长而部分变质,浓度偏低,则所得消耗酸性KMnO4溶液的体积偏大,由此所得n(H2C2O4)偏大,则n(H2O)偏小,x偏低;
③根据化学方程式及各物质之间的关系进行计算.
解答:
解:①KMnO4溶液具有强氧化性,可以腐蚀橡皮管,故KMnO4溶液应装在酸式滴定管中;
KMnO4溶液呈紫色,草酸反应完毕,滴入最后一滴KMnO4溶液,紫色不褪去,说明滴定到终点,不需要外加指示剂,
故答案为:酸;否;紫红色KMnO4溶液被H2C2O4还原为Mn2+时溶液褪色、当最后一滴KMnO4滴入时,溶液中紫红色不再褪去即为滴定终定;
②若滴定用的KMnO4溶液因放置时间过长而部分变质,浓度偏低,由此所得n(H2C2O4)偏大,则n(H2O)偏小,x偏低,故答案为:偏低;
③由2MnO2-+5H2C2O4 +6H+═2Mn2++10CO2↑+8H2O
2mol 5mol
aV×10-3mol 0.025×Cmol
=
解得:C=
mol?L-1
H2C2O4?xH2O~H2C2O4 ~xH2O
1mol 18xg
0.1aV×0.1 w-0.1aV×0.1×90
=
解得x=
.
故答案为:
;
.
KMnO4溶液呈紫色,草酸反应完毕,滴入最后一滴KMnO4溶液,紫色不褪去,说明滴定到终点,不需要外加指示剂,
故答案为:酸;否;紫红色KMnO4溶液被H2C2O4还原为Mn2+时溶液褪色、当最后一滴KMnO4滴入时,溶液中紫红色不再褪去即为滴定终定;
②若滴定用的KMnO4溶液因放置时间过长而部分变质,浓度偏低,由此所得n(H2C2O4)偏大,则n(H2O)偏小,x偏低,故答案为:偏低;
③由2MnO2-+5H2C2O4 +6H+═2Mn2++10CO2↑+8H2O
2mol 5mol
aV×10-3mol 0.025×Cmol
| 2mol |
| aV×10-3mol |
| 5mol |
| 0.025×Cmol |
解得:C=
| aV |
| 10 |
H2C2O4?xH2O~H2C2O4 ~xH2O
1mol 18xg
0.1aV×0.1 w-0.1aV×0.1×90
| 1mol |
| 0.1aV×0.1 |
| 18xg |
| w-0.1aV×0.1×90 |
解得x=
| 50m-45aV |
| 9aV |
故答案为:
| aV |
| 10 |
| 50m-45aV |
| 9aV |
点评:本题考查了滴定操作、滴定应用与计算、物质组成含量测定等,难度中等,注意滴定中经常根据关系式进行计算,掌握根据关系式计算方法.

练习册系列答案
相关题目
常温下单质硫主要以S8形式存在.加热时,S8会转化为S6、S4、S2等.当温度达到750℃时,硫蒸气主要以S2形式存在(占92%).下列说法中正确的是( )
| A、S8转化为S6、S4、S2属于物理变化 |
| B、不论哪种硫分子,完全燃烧时都生成SO2 |
| C、S8、S6、S4、S2均属于共价化合物 |
| D、把硫单质在空气中加热到750℃即得S2 |
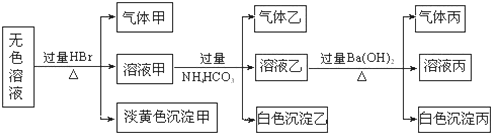
 某课外活动小组,将剪下的一块镀锌铁放入试剂瓶中,并滴入少量食盐水将其浸湿,再加数滴酚酞溶液,按图装置进行实验,数分钟后观察,下列现象不可能出现的是( )
某课外活动小组,将剪下的一块镀锌铁放入试剂瓶中,并滴入少量食盐水将其浸湿,再加数滴酚酞溶液,按图装置进行实验,数分钟后观察,下列现象不可能出现的是( )| A、乙中导气管里形成一段水柱 |
| B、乙中导气管中产生气泡 |
| C、金属片剪口处溶液变红 |
| D、锌被腐蚀 |

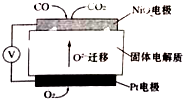 汽车尾气中的主要污染物是NO以及燃料不完全燃烧所产生的CO,它们是现代化城市中的大气污染物.为了减轻大气污染,人们提出通过以下反应来处理汽车尾气:2NO(g)+2CO(g)
汽车尾气中的主要污染物是NO以及燃料不完全燃烧所产生的CO,它们是现代化城市中的大气污染物.为了减轻大气污染,人们提出通过以下反应来处理汽车尾气:2NO(g)+2CO(g)