题目内容
若将密度为1.84g?cm-3浓度为98%的浓硫酸100mL稀释至密度为1.5g?cm-3浓度为9.2mol/L的硫酸需加水多少毫升?
考点:物质的量浓度的相关计算
专题:物质的量浓度和溶解度专题
分析:根据稀硫酸的质量等于浓硫酸的质量加水的质量计算水的体积.
解答:
解:浓硫酸的物质的量浓度为c=
=
=18.4mol/L,
设稀释后硫酸的体积为V,则有0.1L×18.4mol/L=V×9.2mol/L,
V=0.2L,
稀硫酸的质量为:200ml×1.5g?cm-3=300g,
需要浓硫酸的质量为:100ml×1.84g/ml=184g,
所以需要水的质量为300g-184g=116g,
体积为
=116mL,
答:所需水的体积为116mL.
| 1000ρw |
| M |
| 1000×1.84×98% |
| 98 |
设稀释后硫酸的体积为V,则有0.1L×18.4mol/L=V×9.2mol/L,
V=0.2L,
稀硫酸的质量为:200ml×1.5g?cm-3=300g,
需要浓硫酸的质量为:100ml×1.84g/ml=184g,
所以需要水的质量为300g-184g=116g,
体积为
| 116g |
| 1g/mL |
答:所需水的体积为116mL.
点评:本题考查物质的量浓度的有关计算,题目难度不大,本题注意溶液稀释前后物质的量不变,根据稀硫酸的质量等于浓硫酸的质量加水的质量计算水的体积.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列实验过程中产生的变化与对应的图形相符合的是( )
A、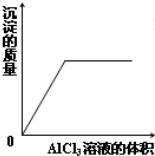 AlCl3溶液滴入NaOH溶液中 |
B、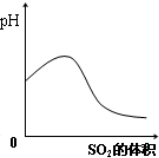 SO2气体通入氢硫酸中 |
C、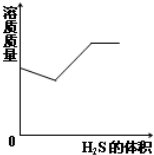 H2S气体通入NaOH溶液中 |
D、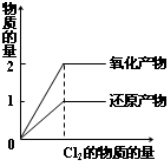 在一定量的H2S水溶液中逐渐通入Cl2 |
某溶液中可能存在Na+、Mg2+、Al3+、Br-、I-、C
、S
等七种离子中的几种.现取该溶液进行实验,得到如下实验现象:①向溶液中滴加足量氯水后,溶液变橙色,且有无色无味气体产生;
②向所得橙色溶液中加入足量BaCl2溶液,无沉淀生成;
③向所得溶液中继续滴加淀粉溶液,溶液不变蓝色.
据此可以推断,该溶液中肯定不存在的离子是( )
| O | 2- 3 |
| O | 2- 3 |
②向所得橙色溶液中加入足量BaCl2溶液,无沉淀生成;
③向所得溶液中继续滴加淀粉溶液,溶液不变蓝色.
据此可以推断,该溶液中肯定不存在的离子是( )
A、Al3+、Mg2+、S
| ||||
B、Mg2+、Na+、C
| ||||
C、Al3+、Na+、S
| ||||
D、Al3+、C
|
有一无色溶液,可能含有K+、Al3+、Mg2+、NH 4+Cl-SO42- HCO3-、Ba2+中的几种.为确定其成分,做如下实验:①取部分溶液,加入适量Na2O2固体,只产生无色无味的气体和白色沉淀,再加入足量的NaOH溶液后白色沉淀部分溶解;②另取部分溶液,加入HNO3酸化的Ba(NO3)2溶液,有白色沉淀产生.下列推断正确的是( )
| A、肯定没有NH4+、HCO3-、Ba2+ |
| B、可能有K+、Cl-、HCO3- |
| C、肯定有Al3+、Mg2+、SO42-、NH4+ |
| D、若另取部分原溶液加入足量AgNO3溶液有白色沉淀生成,证明原溶液中一定有Cl- |
化学与社会、生产、生活密切相关.下列说法不正确的是( )
| A、太阳能电池板中的硅,在元素周期表中处于金属与非金属的交界位置 |
| B、煤的气化或液化技术,可以降低污染 |
| C、镁粉可用来作信号弹和烟花,氧化镁可制作耐高温材料 |
| D、NaHCO3能与碱反应,因此食品工业用小苏打做焙制糕点的膨松剂 |
实验室制乙酸乙酯1mL后,沿器壁加入紫色石蕊试液0.5mL,这时石蕊试液将存在于饱和碳酸钠溶液层与乙酸乙酯层之间(整个过程不振荡).对可能出现的现象,下列叙述中正确的是( )
| A、石蕊层仍为紫色,有机层无色 |
| B、石蕊层为三层环,由上而下是红、紫、红 |
| C、石蕊层有两层,上层为紫色,下层为蓝色 |
| D、石蕊层为三层环,由上而下是蓝、紫、红 |
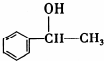 所示.
所示.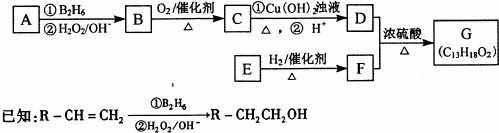
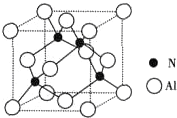
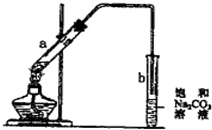 “酒是陈的香”,是因为酒在储存过程中生成了有香味的乙酸乙酯.在实验室我们可以用如图所示的装置来制取乙酸乙酯.回答下列问题:
“酒是陈的香”,是因为酒在储存过程中生成了有香味的乙酸乙酯.在实验室我们可以用如图所示的装置来制取乙酸乙酯.回答下列问题: