题目内容
某氮铝化合物X具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于陶瓷工业等领域.
(1)基态氮原子的核外电子排布式为 .
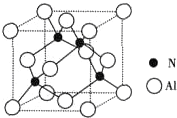
(2)工业上用氧化铝与氮气和碳在一定条件下反应生成X和CO,X的晶体结构如图所示,其化学式 ,工业制备X的化学方程式为 .
(3)X晶体中包含的化学键类型为 .(填字母标号)A.离子键B.共价键C.配位键D.金属键
X晶体中氮原子的杂化类型为 杂化.
(4)已知氮化硼与X晶体类型相同,且氮化硼的熔点比X高,可能的原因是 .
(5)若X的密度为ρg/cm3,则晶体中最近的两个N原子的距离为 cm.(阿伏加德罗常数的值用NA表示)

(1)基态氮原子的核外电子排布式为
(2)工业上用氧化铝与氮气和碳在一定条件下反应生成X和CO,X的晶体结构如图所示,其化学式
(3)X晶体中包含的化学键类型为
X晶体中氮原子的杂化类型为
(4)已知氮化硼与X晶体类型相同,且氮化硼的熔点比X高,可能的原因是
(5)若X的密度为ρg/cm3,则晶体中最近的两个N原子的距离为
考点:晶胞的计算,原子核外电子排布,原子轨道杂化方式及杂化类型判断
专题:
分析:(1)氮是7号元素,核外电子数是5,依据构造原理书写电子排布式;
(2)根据X的晶体结构图可知,晶胞中含有氮原子为4,含有铝原子
×8+
=4,所以X的化学式为AlN,根据元素守恒可以写出化学方程式;
(3)由AlN的晶胞结构可知,一个N原子与距离最近的四个Al原子成键,因此N采取sp3杂化,根据X的结构可知,每个铝和氮周围都有四个共价键,都达八电子稳定结构,而铝原子最外层原来只有三个电子,氮原子最外层有5个电子,所以在AlN中有配位键,根据AlN的性质可知它为原子晶体,所以晶体中含有共价键,据此答题;
(4)氮化硼与AlN相比,硼原子半径比铝原子半径小,所以键能就大,它们都是原子晶体,所以氮化硼的熔点比AlN高;
(5)晶体N原子位于晶胞体对角线的
处,将体心与下底面相对的两顶点相连可构成等腰三角形,距离最近的两个N原子相连的连线为该三角形的中位线,所以晶体中最近的两个N原子的距离为底面对角线的
,根据晶胞的密度可以求得晶胞边长,进而求得底面对角线的长度,据此可解题.
(2)根据X的晶体结构图可知,晶胞中含有氮原子为4,含有铝原子
| 1 |
| 8 |
| 1 |
| 2 |
(3)由AlN的晶胞结构可知,一个N原子与距离最近的四个Al原子成键,因此N采取sp3杂化,根据X的结构可知,每个铝和氮周围都有四个共价键,都达八电子稳定结构,而铝原子最外层原来只有三个电子,氮原子最外层有5个电子,所以在AlN中有配位键,根据AlN的性质可知它为原子晶体,所以晶体中含有共价键,据此答题;
(4)氮化硼与AlN相比,硼原子半径比铝原子半径小,所以键能就大,它们都是原子晶体,所以氮化硼的熔点比AlN高;
(5)晶体N原子位于晶胞体对角线的
| 1 |
| 2 |
| 1 |
| 2 |
解答:
解:(1)氮是7号元素,核外电子数是5,核外电子排布式为1s22s22p3,故答案为:1s22s22p3;
(2)根据X的晶体结构图可知,晶胞中含有氮原子为4,含有铝原子
×8+
=4,所以X的化学式为AlN,氧化铝与氮气和碳在一定条件下反应的化学方程式为Al2O3+N2+3C=2AlN+3CO,故答案为:AlN;Al2O3+N2+3C=2AlN+3CO;
(3)由AlN的晶胞结构可知,一个N原子与距离最近的四个Al原子成键,因此N采取sp3杂化,根据X的结构可知,每个铝和氮周围都有四个共价键,都达八电子稳定结构,而铝原子最外层原来只有三个电子,氮原子最外层有5个电子,所以在AlN中有配位键,根据AlN的性质可知它为原子晶体,所以晶体中含有共价键,
故答案为:BC;sp3;
(4)氮化硼与AlN相比,硼原子半径比铝原子半径小,所以键能就大,它们都是原子晶体,所以氮化硼的熔点比AlN高,
故答案为:氮化硼与氮化铝均为原子晶体,且硼原子半径小于铝原子半径,B-N键键能大于Al-N键键能;
(5)晶体N原子位于晶胞体对角线的
处,将体心与下底面相对的两顶点相连可构成等腰三角形,距离最近的两个N原子相连的连线为该三角形的中位线,所以晶体中最近的两个N原子的距离为底面对角线的
,
根据晶胞的密度ρ=
,可以求得晶胞边长为
cm,
进而求得底面对角线的长度为
?
cm,所以晶体中最近的两个N原子的距离为
?
cm,
故答案为:
?
.
(2)根据X的晶体结构图可知,晶胞中含有氮原子为4,含有铝原子
| 1 |
| 8 |
| 1 |
| 2 |
(3)由AlN的晶胞结构可知,一个N原子与距离最近的四个Al原子成键,因此N采取sp3杂化,根据X的结构可知,每个铝和氮周围都有四个共价键,都达八电子稳定结构,而铝原子最外层原来只有三个电子,氮原子最外层有5个电子,所以在AlN中有配位键,根据AlN的性质可知它为原子晶体,所以晶体中含有共价键,
故答案为:BC;sp3;
(4)氮化硼与AlN相比,硼原子半径比铝原子半径小,所以键能就大,它们都是原子晶体,所以氮化硼的熔点比AlN高,
故答案为:氮化硼与氮化铝均为原子晶体,且硼原子半径小于铝原子半径,B-N键键能大于Al-N键键能;
(5)晶体N原子位于晶胞体对角线的
| 1 |
| 4 |
| 1 |
| 2 |
根据晶胞的密度ρ=
| ||
| 晶体边长3 |
| 3 |
| ||
进而求得底面对角线的长度为
| 2 |
| 3 |
| ||
| ||
| 2 |
| 3 |
| ||
故答案为:
| ||
| 2 |
| 3 |
| ||
点评:本题考查了原子核外电子排布图、均摊法晶胞的计算、键能与性质的关系、以及晶胞结构的计算等知识,为高考选作真题,难度较大,其中晶胞的计算是该题的难点.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
在某100mL混合酸中,硝酸物质的量浓度为0.4mol/L,硫酸物质的量浓度为0.2mol/L,向其中加入3.2g铜粉,微热,待其充分反应后,溶液中铜离子的物质的量浓度约为( )
| A、0.15mol/L |
| B、0.3mol/L |
| C、0.5mol/L |
| D、无法计算 |
把足量的小苏打固体和少量的过氧化钠固体混合均匀后充分加热,最后留下的固体物质的化学式是( )
| A、Na2CO3 |
| B、NaOH和Na2CO3 |
| C、Na2O2和Na2CO3 |
| D、Na2O2、NaOH和Na2CO3 |
 乙醇是一种非常重要的烃的衍生物,是无色有特殊气味的液体.某校化学兴趣小组对乙醇的结构和性质进行了以下探究,请你参与并完成对有关问题的解答.
乙醇是一种非常重要的烃的衍生物,是无色有特殊气味的液体.某校化学兴趣小组对乙醇的结构和性质进行了以下探究,请你参与并完成对有关问题的解答. A、B、C、D、E、F六种元素,其中A、B、C、D、E为短周期主族元素.它们之间的关系如下:
A、B、C、D、E、F六种元素,其中A、B、C、D、E为短周期主族元素.它们之间的关系如下:
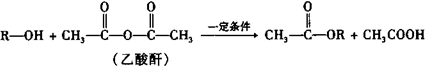
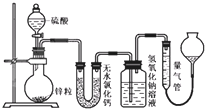 不同浓度的硫酸与锌反应时,产物不同,为了验证这一事实,某同学拟用如图装置进行实验(假设实验条件为压强为101kPa,温度为0℃).
不同浓度的硫酸与锌反应时,产物不同,为了验证这一事实,某同学拟用如图装置进行实验(假设实验条件为压强为101kPa,温度为0℃).