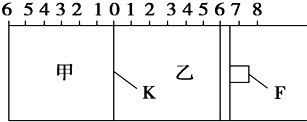
题目内容
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压.高铁电池的总反应为:3Zn+2K2O4+8H2O
3Zn(OH)2+2Fe(OH)3+2Fe(OH)3+4KOH下列叙述不正确的是( )
| 放电 |
| 充电 |
| A、放电时负极反应为:3Zn-6e-+6OH-═3Zn(OH)2 |
| B、放电时正极反应为:2FeO42-+6e-+8H2O═2Fe(OH)3+10OH- |
| C、放电时每转移3mol电子,正极有1mol K2FeO4被氧化 |
| D、放电时正极附近溶液的碱性增强 |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:根据电池反应式知,放电时,锌失电子而作负极,电极反应式为Zn-2e-+2OH-=Zn(OH)2,高铁酸钾得电子而作正极,电极反应式为FeO42-+4H2O+3e-=Fe(OH)3+5OH-,充电时,充电时,阳极反应和放电时的正极反应是互为逆反应,阴极上的反应和放电时的负极反应是互为逆反应.
解答:
解:A.放电时,Zn失去电子,发生Zn-2e-+2OH-=Zn(OH)2,故A正确;
B.放电时正极反应为:FeO42-+4H2O+3e=Fe(OH)3-+5OH-,故B正确;
C.放电时正极转化为:FeO42-→Fe(OH)3,1mol K2FeO4被还原要得到3mol电子,故C错误;
D.放电时正极反应为:FeO42-+4H2O+3e=Fe(OH)3-+5OH-,生成氢氧根离子,所以正极附近溶液的碱性增强,故D正确;
故选C.
B.放电时正极反应为:FeO42-+4H2O+3e=Fe(OH)3-+5OH-,故B正确;
C.放电时正极转化为:FeO42-→Fe(OH)3,1mol K2FeO4被还原要得到3mol电子,故C错误;
D.放电时正极反应为:FeO42-+4H2O+3e=Fe(OH)3-+5OH-,生成氢氧根离子,所以正极附近溶液的碱性增强,故D正确;
故选C.
点评:本题考查可充电电池,放电为原电池,充电为电解池,要注意电池内部环境的酸碱性.

练习册系列答案
相关题目
下列物质长期暴露在空气中会氧化变质的是( )
| A、CuSO4溶液 |
| B、NaOH溶液 |
| C、FeSO4溶液 |
| D、NaCl溶液 |
有关如图装置的叙述不正确的是( )
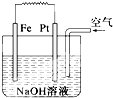

| A、这是电解NaOH溶液的装置 |
| B、该装置中Pt为正极,电极反应为O2+2H2O+4e-═4OH- |
| C、该装置中Fe为负极,电极反应为Fe-2e-═Fe2+ |
| D、这是一个原电池装置 |
下列说法错误的是( )
| A、在水中的溶解度NH3>CH4 |
| B、晶体熔点的高低SiO2>CO2 |
| C、金属键的强弱Li>K |
| D、晶格能的大小NaF>MgO |
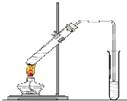 “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题: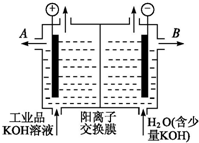 铝和氢氧化钾都是重要的工业产品.请回答:
铝和氢氧化钾都是重要的工业产品.请回答: