题目内容
有关如图装置的叙述不正确的是( )
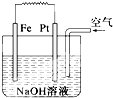

| A、这是电解NaOH溶液的装置 |
| B、该装置中Pt为正极,电极反应为O2+2H2O+4e-═4OH- |
| C、该装置中Fe为负极,电极反应为Fe-2e-═Fe2+ |
| D、这是一个原电池装置 |
考点:原电池和电解池的工作原理
专题:
分析:该原电池中,铁发生吸氧腐蚀,铁易失电子作负极、铂丝作正极,负极上电极反应式为Fe-2e-+2OH-═Fe(OH)2,正极电极反应式为O2+2H2O+4e-═4OH-,再结合物质性质分析解答.
解答:
解:A、该装置中铁发生吸氧腐蚀,是将化学能转化为电能,为原电池,故A错误;
B、该装置中Pt作正极,正极上氧气得电子发生还原反应,电极反应式为O2+2H2O+4e-═4OH-,故B正确;
C、该装置中Fe为负极,在NaOH溶液中电极反应为:Fe-2e-+2OH-═Fe(OH)2,故C错误;
D、该装置中铁发生吸氧腐蚀,是将化学能转化为电能,为原电池,故D正确;
故选AC.
B、该装置中Pt作正极,正极上氧气得电子发生还原反应,电极反应式为O2+2H2O+4e-═4OH-,故B正确;
C、该装置中Fe为负极,在NaOH溶液中电极反应为:Fe-2e-+2OH-═Fe(OH)2,故C错误;
D、该装置中铁发生吸氧腐蚀,是将化学能转化为电能,为原电池,故D正确;
故选AC.
点评:本题考查了原电池原理,明确铁发生吸氧腐蚀和析氢腐蚀的条件是解本题关键,会书写电极反应式,题目难度不大.

练习册系列答案
相关题目
铜片和下列哪种酸不反应( )
| A、浓盐酸 | B、浓硫酸 |
| C、浓硝酸 | D、稀硝酸 |
常温下,把pH=3的盐酸溶液和pH=10的Ba(OH)2溶液混合,若混合溶液的pH为7,则盐酸溶液和Ba(OH)2溶液的体积比是( )
| A、1:10 | B、1:5 |
| C、1:2 | D、2:1 |
a molNa2O2和b molNaHCO3固体混合后,在密闭容器中加热到250℃,使其充分反应,当排出气体为两种气体时,a:b不可能为( )
| A、3:4 | B、4:5 |
| C、2:3 | D、3:2 |
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压.高铁电池的总反应为:3Zn+2K2O4+8H2O
3Zn(OH)2+2Fe(OH)3+2Fe(OH)3+4KOH下列叙述不正确的是( )
| 放电 |
| 充电 |
| A、放电时负极反应为:3Zn-6e-+6OH-═3Zn(OH)2 |
| B、放电时正极反应为:2FeO42-+6e-+8H2O═2Fe(OH)3+10OH- |
| C、放电时每转移3mol电子,正极有1mol K2FeO4被氧化 |
| D、放电时正极附近溶液的碱性增强 |
已知在1×105 Pa、298K条件下,2mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是( )
| A、2H2(g)+O2(g)═2H2O(g)△H=+484 kJ?mol-1 |
| B、H2O(g)═H2(g)+O2(g)△H=+242 kJ?mol-1 |
| C、H2(g)+O2(g)═H2O(g)△H=+242 kJ?mol-1 |
| D、2H2(g)+O2(g)═2H2O(l)△H=-484 kJ?mol-1 |
下列推断或表述正确的是( )
| A、25°时,有pH=a的醋酸溶液,将此溶液稀释1倍后,溶液的pH=b,则a>b |
| B、向2.0mL浓度均为0.1mol?L-1的KCl、KI混合液滴加1~2滴0.01 mol?L-1AgNO3溶液,振荡,沉淀呈黄色,说明AgCl的Ksp比AgI的Ksp小 |
| C、0.2mol/L的一元酸HX与0.1mol/L的KOH溶液等体积混合所得溶液中,一定有:c(H+)+c(K+)═c(OH-)+c(X-) |
| D、25°时,0.2mol?L-1盐酸与等体积0.05mol?L-1Ba(OH)2溶液混合后,溶液pH为1 |