题目内容
5.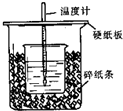 用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:(1)从实验装置上看,图中尚缺少的一种玻璃用品是环形玻璃搅拌棒,装置的主要缺点是小烧杯口和大烧杯口没有平齐.
(2)烧杯间填满碎纸条的作用是减少实验过程中的热量损失.
(3)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量不相等(填“相等、不相等”),所求中和热相等(填“相等、不相等”),简述理由因中和热是指稀强酸与稀强碱发生中和反应生成1 molH2O放出的热量,与酸碱的用量无关.
(4)用相同浓度和体积的氨水(NH3•H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会偏小;(填“偏大”、“偏小”、“无影响”).
(5)用相同量的浓硫酸代替盐酸进行上述实验,测得的中和热的数值会偏大;(填“偏大”、“偏小”、“无影响”).
分析 (1)根据量热计的构造来判断该装置的缺少仪器;根据中和热的测定原理分析;
(2)中和热测定实验成败的关键是保温工作;
(3)反应放出的热量和所用酸以及碱的量的多少有关,并根据中和热的概念和实质来回答;
(4)根据弱电解质电离吸热分析;
(5)浓硫酸在稀释过程中会放出大量的热量.
解答 解:(1)由量热计的构造可知该装置的缺少仪器是环形玻璃搅拌棒;中和热测定实验成败的关键是保温工作,内外烧杯为一样高,否则,热量散失大;
故答案为:环形玻璃搅拌棒;小烧杯口和大烧杯口没有平齐;
(2)中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎纸条的作用是减少实验过程中的热量损失;
故答案为:减少实验过程中的热量损失;
(3)反应放出的热量和所用酸以及碱的量的多少有关,如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,生成水的量增多,所放出的热量偏高,但是中和热的均是强酸和强碱反应生成1mol水时放出的热,与酸碱的用量无关,中和热数值相等,
故答案为:不相等;相等;因中和热是指稀强酸与稀强碱发生中和反应生成1 molH2O放出的热量,与酸碱的用量无关;
(4)一水合氨为弱碱,电离过程为吸热过程,所以用氨水代替稀氢氧化钠溶液反应,反应放出的热量偏小;
故答案为:偏小;
(5)浓硫酸在稀释过程中会放出大量的热量,导致中和热的数值会偏高,故答案为:偏大.
点评 本题考查学生有关中和热的测定原理和仪器,掌握测定的原理是解题的关键,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
13.下列关于NaOH溶液和氨水的说法正确的是( )
| A. | 相同浓度的两溶液中c(OH-) 相同 | |
| B. | pH=13的两溶液稀释100倍,pH都为11 | |
| C. | 100 mL 0.1 mol/L的两溶液能中和等物质的量的盐酸 | |
| D. | 两溶液中分别加入少量对应的硫酸盐固体,c(OH-) 均明显减小 |
10.已知如下物质的溶度积常数:FeS:Ksp=6.3×10-18;CuS:Ksp=1.3×10-36;ZnS:Ksp=1.6×10-24.下列说法正确的是( )
| A. | 同温度下,CuS的溶解度大于ZnS的溶解度 | |
| B. | 将足量CuSO4溶解在0.1 mol•L-1的H2S溶液中,Cu2+能达到的最大浓度为1.3×10-35 mol•L-1 | |
| C. | 因为H2SO4是强酸,故CuSO4+H2S═CuS↓+H2SO4不能发生 | |
| D. | 除去工业废水中的Cu2+,可以选用FeS作沉淀剂 |
14.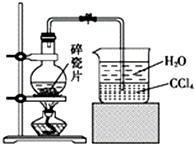 1-溴异戊烷[(CH3)2CHCH2CH2Br]是有机合成的重要中间体,可用于生产染料、催化剂等,其沸点为121℃,易溶于CCl4,可由异戊醇与氢溴酸在硫酸催化作用下反应而得:(CH3)2CHCH2CH2OH+HBr$\stackrel{△}{→}$(CH3)2CHCH2CH2Br+H2O.已知异戊醇的沸点为132.5℃,微溶于水,易溶于CCl4.实验室制备1-溴异戊烷的装置如图所示.
1-溴异戊烷[(CH3)2CHCH2CH2Br]是有机合成的重要中间体,可用于生产染料、催化剂等,其沸点为121℃,易溶于CCl4,可由异戊醇与氢溴酸在硫酸催化作用下反应而得:(CH3)2CHCH2CH2OH+HBr$\stackrel{△}{→}$(CH3)2CHCH2CH2Br+H2O.已知异戊醇的沸点为132.5℃,微溶于水,易溶于CCl4.实验室制备1-溴异戊烷的装置如图所示.
请回答下列问题:
(1)上述实验装置中长导管的作用是冷凝回流;导管末端插入CCl4中而不直接插入水中,除了能将挥发出的Br2、1-溴异戊烷等充分吸收外,另一个重要作用是防止倒吸.
(2)将1-溴异戊烷的粗产品置于分液漏斗中加水,振荡后静置,有机物将在下层(填“在上层”、“在下层”或“不分层”).
(3)在制备过程中,Br-可被氧化为Br2而引入杂质.欲除去Br2,可选用CE(填字母).
A.NaCl B.NaOH C.NaHSO3 D.KCl E.NaHCO3
(4)在制备1-溴异戊烷时,不能边反应边蒸出产物,其原因是1-溴丁烷与正丁醇的沸点差较小,若边反应边蒸出产物,会有较多的正丁醇挥发,降低原料的利用率.
(5)在实验室中还可用NaBr、浓H2SO4和异戊醇为原料制备1-溴异戊烷.已知反应物的用量如表:
若实验时1-溴异戊烷的产率为40%,则可制取1-溴异戊烷15.1g.
 1-溴异戊烷[(CH3)2CHCH2CH2Br]是有机合成的重要中间体,可用于生产染料、催化剂等,其沸点为121℃,易溶于CCl4,可由异戊醇与氢溴酸在硫酸催化作用下反应而得:(CH3)2CHCH2CH2OH+HBr$\stackrel{△}{→}$(CH3)2CHCH2CH2Br+H2O.已知异戊醇的沸点为132.5℃,微溶于水,易溶于CCl4.实验室制备1-溴异戊烷的装置如图所示.
1-溴异戊烷[(CH3)2CHCH2CH2Br]是有机合成的重要中间体,可用于生产染料、催化剂等,其沸点为121℃,易溶于CCl4,可由异戊醇与氢溴酸在硫酸催化作用下反应而得:(CH3)2CHCH2CH2OH+HBr$\stackrel{△}{→}$(CH3)2CHCH2CH2Br+H2O.已知异戊醇的沸点为132.5℃,微溶于水,易溶于CCl4.实验室制备1-溴异戊烷的装置如图所示.请回答下列问题:
(1)上述实验装置中长导管的作用是冷凝回流;导管末端插入CCl4中而不直接插入水中,除了能将挥发出的Br2、1-溴异戊烷等充分吸收外,另一个重要作用是防止倒吸.
(2)将1-溴异戊烷的粗产品置于分液漏斗中加水,振荡后静置,有机物将在下层(填“在上层”、“在下层”或“不分层”).
(3)在制备过程中,Br-可被氧化为Br2而引入杂质.欲除去Br2,可选用CE(填字母).
A.NaCl B.NaOH C.NaHSO3 D.KCl E.NaHCO3
(4)在制备1-溴异戊烷时,不能边反应边蒸出产物,其原因是1-溴丁烷与正丁醇的沸点差较小,若边反应边蒸出产物,会有较多的正丁醇挥发,降低原料的利用率.
(5)在实验室中还可用NaBr、浓H2SO4和异戊醇为原料制备1-溴异戊烷.已知反应物的用量如表:
| 反应物 | NaBr | 98.3% 浓H2SO4 | 异戊醇 | 水 |
| 用量 | 0.30mol | 35mL(过量) | 0.25mol | 30mL |
15.常温下,下列溶液的pH或微粒的物质的量浓度关系正确的是( )
| A. | 某溶液中由水电离出的c(H+)=1×10-amol•L-1,若a>7时,则该溶液的pH一定为14-a | |
| B. | 将0.2mol•L-1的某一元酸HA溶液和0.1mol•L-1的NaOH溶液等体积混合后溶液的pH大于7,则反应后的混合液:c(HA)>c(A-) | |
| C. | Na2CO3溶液:c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) | |
| D. | 常温下NaHSO3溶液的pH<7,溶液中c(SO32-)<c(H2SO3) |
 .
.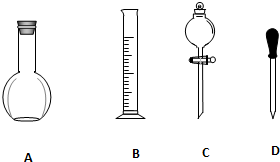 实验室需要0.1mol/L NaOH溶液900mL和0.5mol/L的硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题.
实验室需要0.1mol/L NaOH溶液900mL和0.5mol/L的硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题.
 铜及其化合物在科学研究和工业生产中具有许多用途.
铜及其化合物在科学研究和工业生产中具有许多用途. ;
;