题目内容
15.常温下,下列溶液的pH或微粒的物质的量浓度关系正确的是( )| A. | 某溶液中由水电离出的c(H+)=1×10-amol•L-1,若a>7时,则该溶液的pH一定为14-a | |
| B. | 将0.2mol•L-1的某一元酸HA溶液和0.1mol•L-1的NaOH溶液等体积混合后溶液的pH大于7,则反应后的混合液:c(HA)>c(A-) | |
| C. | Na2CO3溶液:c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) | |
| D. | 常温下NaHSO3溶液的pH<7,溶液中c(SO32-)<c(H2SO3) |
分析 A.常温时,某溶液中由水电离出的c(H+)=1×10-a mol/L,若a>7时,说明水的电离受到抑制,可能为酸溶液,也可能为碱溶液;
B.混合液呈碱性,则HA的电离程度小于A-的水解程度,则c(HA)>c(A-);
C.根据碳酸钠溶液中的物料守恒判断;
D.亚硫酸氢钠溶液呈酸性,说明亚硫酸氢根离子的电离程度大于其水解程度.
解答 解:A.常温时,某溶液中由水电离出的c(H+)=1×10-a mol/L,若a>7时,说明水的电离受到抑制,可能为酸溶液,也可能为碱溶液,如为酸溶液,则pH=a,如为碱溶液,则pH=14-a,故A错误;
B.将0.2mol•L-1的某一元酸HA溶液和0.1mol•L-1的NaOH溶液等体积混合后溶液的pH大于7,混合液呈碱性,则HA的电离程度小于A-的水解程度,则反应后的混合液中:c(HA)>c(A-),故B正确;
C.Na2CO3溶液中,根据物料守恒可得:c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3),故C错误;
D.常温下NaHSO3溶液的pH<7,说明亚硫酸氢根离子的水解程度小于电离程度,则溶液中c(SO32-)>c(H2SO3),故D错误;
故选B.
点评 本题考查了离子浓度大小比较,题目难度中等,明确盐的水解原理及其影响为解答关键,注意掌握电荷守恒、物料守恒的含义及应用方法,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案
相关题目
6.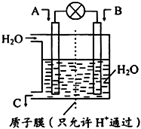 燃煤能排放大量的CO、CO2、SO2,PM2.5(可入肺颗粒物)污染也跟冬季燃煤密切相关.SO2、CO、CO2也是对环境影响较大的气体,对它们的合理控制、利用是优化我们生存环境的有效途径.
燃煤能排放大量的CO、CO2、SO2,PM2.5(可入肺颗粒物)污染也跟冬季燃煤密切相关.SO2、CO、CO2也是对环境影响较大的气体,对它们的合理控制、利用是优化我们生存环境的有效途径.
(1)如图所示,利用电化学原理将SO2 转化为重要化工原料C若A为SO2,B为O2,则负极的电极反应式为:SO2+2H2O-2e-=SO42-+4H+;
(2)有一种用CO2生产甲醇燃料的方法:CO2+3H2?CH3OH+H2O
已知:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-a kJ•mol-1;
2H2(g)+O2(g)=2H2O(g)△H=-b kJ•mol-1;
H2O(g)=H2O(l)△H=-c kJ•mol-1;
CH3OH(g)=CH3OH(l)△H=-d kJ•mol-1,
则表示CH3OH(l)燃烧热的热化学方程式为:CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-($\frac{3}{2}$c+2d-a-b)kJ•mol-1;
(3)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
①该反应的△H<0(填“>”或“<”),实验2条件下平衡常数K=0.17.
②实验3中,若平衡时,CO的转化率大于水蒸气,则$\frac{a}{b}$的值0<$\frac{a}{b}$<1(填具体值或取值范围).
③实验4,若900℃时,在此容器中加入CO、H2O、CO2、H2均为1mol,则此时V正<V逆(填“<”,“>”,“=”).
④判断该反应达到平衡的依据是AC.
A.CO2减少的化学反应速率和CO减少的化学反应速率相等
B.容器内气体压强保持不变
C.CO、H2O、CO2、H2的浓度都不再发生变化
D.容器中气体的平均相对分子质量不随时间而变化.
 燃煤能排放大量的CO、CO2、SO2,PM2.5(可入肺颗粒物)污染也跟冬季燃煤密切相关.SO2、CO、CO2也是对环境影响较大的气体,对它们的合理控制、利用是优化我们生存环境的有效途径.
燃煤能排放大量的CO、CO2、SO2,PM2.5(可入肺颗粒物)污染也跟冬季燃煤密切相关.SO2、CO、CO2也是对环境影响较大的气体,对它们的合理控制、利用是优化我们生存环境的有效途径.(1)如图所示,利用电化学原理将SO2 转化为重要化工原料C若A为SO2,B为O2,则负极的电极反应式为:SO2+2H2O-2e-=SO42-+4H+;
(2)有一种用CO2生产甲醇燃料的方法:CO2+3H2?CH3OH+H2O
已知:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-a kJ•mol-1;
2H2(g)+O2(g)=2H2O(g)△H=-b kJ•mol-1;
H2O(g)=H2O(l)△H=-c kJ•mol-1;
CH3OH(g)=CH3OH(l)△H=-d kJ•mol-1,
则表示CH3OH(l)燃烧热的热化学方程式为:CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-($\frac{3}{2}$c+2d-a-b)kJ•mol-1;
(3)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需 时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
②实验3中,若平衡时,CO的转化率大于水蒸气,则$\frac{a}{b}$的值0<$\frac{a}{b}$<1(填具体值或取值范围).
③实验4,若900℃时,在此容器中加入CO、H2O、CO2、H2均为1mol,则此时V正<V逆(填“<”,“>”,“=”).
④判断该反应达到平衡的依据是AC.
A.CO2减少的化学反应速率和CO减少的化学反应速率相等
B.容器内气体压强保持不变
C.CO、H2O、CO2、H2的浓度都不再发生变化
D.容器中气体的平均相对分子质量不随时间而变化.
7.按钠、钾、铷、铯的顺序,下列有关叙述正确的是( )
| A. | 其氢氧化物中碱性最强的是NaOH | B. | 单质还原能力最强的是钠 | ||
| C. | 单质的与水反应时钠最剧烈 | D. | 原子半径逐渐增大 |
4.中学化学中很多“规律”都有适用范围,下列根据有关“规律”推出的结论正确的是( )
| 选项 | 规律 | 结论 |
| A | 较强酸可以制取较弱酸 | 次氯酸溶液无法制取盐酸 |
| B | 反应物浓度越大,反应速率越快 | 常温下,相同的铝片中分别加入足量的浓、稀硝酸,浓硝酸中铝片先溶解完 |
| C | 结构和组成相似的物质,沸点随相对分子质量增大而升高 | NH3沸点低于PH3 |
| D | 溶解度小的沉淀易向溶解度更小的沉淀转化 | AgCl沉淀中滴加NaI溶液可以得到AgI沉淀 |
| A. | A | B. | B | C. | C | D. | D |
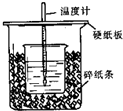 用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
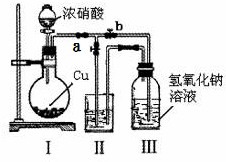 针对网络上流传的隔夜熟肉中因亚硝酸钠(NaNO2)含量严重超标而不能食用的说法,某兴趣小组开展如下探究活动:
针对网络上流传的隔夜熟肉中因亚硝酸钠(NaNO2)含量严重超标而不能食用的说法,某兴趣小组开展如下探究活动: