题目内容
9. 科学家用氮化镓材料与铜组装成如图所示的人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4.下列关于该电池叙述错误的是( )
科学家用氮化镓材料与铜组装成如图所示的人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4.下列关于该电池叙述错误的是( )| A. | 电池工作时,是将太阳能转化为电能 | |
| B. | 铜电极为正极,电极反应式为:CO2+8e-+8H+=CH4+2H2O | |
| C. | 电池内部H+透过质子交换膜从左向右移动 | |
| D. | 为提高该人工光合系统的工作效率,可向装置中加入少量盐酸 |
分析 该装置中,根据电子流向知,GaN是负极、Cu是正极,负极反应式为:2H2O-4e-=4H++O2↑,正极反应式为:CO2+8e-+8H+=CH4+2H2O,电解质溶液中阳离子向正极移动,据此分析解答.
解答 解:A.根据图示可知,该装置中将太阳能转化为化学能的过程,故A错误;
B.根据电子流向知,Cu是正极,正极上二氧化碳得电子和氢离子反应生成甲烷,电极反应式为:CO2+8e-+8H+=CH4+2H2O,故B正确;
C.放电时,电解质溶液中阳离子向正极移动,所以装置中的H+由左向右移动,故C正确;
D.可向装置中加入少量的酸作电解质,由于盐酸易挥发,生成的甲烷中会混有HCl气体,应加入硫酸,故D错误;
故选AD.
点评 本题考查化学电源新型电池,题目难度中等,明确原电池原理为解答根据,注意正确判断电极反应、电子流向、离子流向,难点是电极反应式的书写.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
19.下列说法不正确的是( )
| A. | 二甲苯和四甲苯均有三种 | |
| B. | 乙醇的酯化反应和酯的水解均属于取代反应 | |
| C. | 乙醇、乙酸均可与金属钠反应 | |
| D. | 石油裂解和油脂皂化均是由高分子物质生成小分子物质的过程 |
1. 25℃时,三种酸的电离平衡常数如下:
25℃时,三种酸的电离平衡常数如下:
回答下列问题:
(1)一般情况下,当温度升高时,Ka增大(填“增大”、“减小”或“不变”).
(2)下列四种离子结合质子能力由大到小的顺序是a>b>d>c(填序号);
a.CO32-b.ClO- c.CH3COO-d.HCO3-
(3)下列反应不能发生的是cd(填序号)
a.CO32-+CH3COOH=CH3COO-+CO2↑+H2O
b.ClO-+CH3COOH=CH3COO-+HClO
c.CO32-+2HClO=CO2↑+H2O+2ClO-
d.2ClO-+CO2+H2O=CO32-+2HClO
(4)用蒸馏水稀释0.10mol•L-1的醋酸,下列各式表示的数值随水量的增加而增大的是b(填序号);
a.$\frac{c(C{H}_{3}COOH)}{c({H}^{+})}$b.$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$ c.$\frac{c({H}^{+})}{{k}_{W}}$ d.$\frac{c({H}^{+})}{c(O{H}^{-})}$
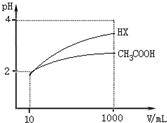
(5)体积均为10mL、pH均为2的醋酸溶液与HX溶液分别加水稀释至1000mL,稀释过程中pH变化如图所示.
则HX的电离平衡常数大于(填“大于”、“等于”或“小于”,下同)醋酸的电离平衡常数;稀释后,HX溶液中水电离出来的c(H+)大于醋酸溶液中水电离出来的c(H+),理由是稀释后HX溶液中的c(H+)小于CH3COOH溶液中的c(H+),它对水的电离的抑制能力减弱;
(6)25℃时,若测得CH3COOH与CH3COONa的混合溶液的pH=6,则溶液中c(CH3COO-)-c(Na+)=9.9×10-7 mol•L-1(填精确数值).
 25℃时,三种酸的电离平衡常数如下:
25℃时,三种酸的电离平衡常数如下:| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.8×10-5 | K1 4.3×10-7 K2 5.6×10-11 | 3.0×10-8 |
(1)一般情况下,当温度升高时,Ka增大(填“增大”、“减小”或“不变”).
(2)下列四种离子结合质子能力由大到小的顺序是a>b>d>c(填序号);
a.CO32-b.ClO- c.CH3COO-d.HCO3-
(3)下列反应不能发生的是cd(填序号)
a.CO32-+CH3COOH=CH3COO-+CO2↑+H2O
b.ClO-+CH3COOH=CH3COO-+HClO
c.CO32-+2HClO=CO2↑+H2O+2ClO-
d.2ClO-+CO2+H2O=CO32-+2HClO
(4)用蒸馏水稀释0.10mol•L-1的醋酸,下列各式表示的数值随水量的增加而增大的是b(填序号);
a.$\frac{c(C{H}_{3}COOH)}{c({H}^{+})}$b.$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$ c.$\frac{c({H}^{+})}{{k}_{W}}$ d.$\frac{c({H}^{+})}{c(O{H}^{-})}$
(5)体积均为10mL、pH均为2的醋酸溶液与HX溶液分别加水稀释至1000mL,稀释过程中pH变化如图所示.
则HX的电离平衡常数大于(填“大于”、“等于”或“小于”,下同)醋酸的电离平衡常数;稀释后,HX溶液中水电离出来的c(H+)大于醋酸溶液中水电离出来的c(H+),理由是稀释后HX溶液中的c(H+)小于CH3COOH溶液中的c(H+),它对水的电离的抑制能力减弱;
(6)25℃时,若测得CH3COOH与CH3COONa的混合溶液的pH=6,则溶液中c(CH3COO-)-c(Na+)=9.9×10-7 mol•L-1(填精确数值).

 .
.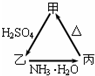 甲、乙、丙三种物质之间有如右图所示的转化关系:
甲、乙、丙三种物质之间有如右图所示的转化关系: