题目内容
18.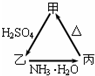 甲、乙、丙三种物质之间有如右图所示的转化关系:
甲、乙、丙三种物质之间有如右图所示的转化关系:(1)若甲是不溶于水的白色粉末状物质,既能溶于盐酸又能溶于氢氧化钠溶液,则甲是Al2O3(填化学式).
写出反应的化学方程式
①甲→乙Al2O3+3H2SO4=Al2(SO4)3+3H2O.
②乙→丙Al2(SO4)3+6NH3•H2O=2Al(OH)3↓+3(NH4)2SO4.
(2)若乙溶液中加入KSCN溶液,有血红色出现,则甲物质是Fe2O3(填化学式).写出反应的离子方程式:
①甲→乙Fe2O3+6H+=Fe3++3H2O.
②乙→丙Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+.
分析 (1)若甲是不溶于水的白色粉末状物质,既能溶于盐酸又能溶于氢氧化钠溶液,则甲是Al2O3,乙是Al2(SO4)3,丙是Al(OH)3;
(2)若乙溶液中加入KSCN溶液,有血红色出现,则甲是 Fe2O3,乙是Fe2(SO4)3,丙是Fe(OH)3.
解答 解:(1)若甲是不溶于水的白色粉末状物质,既能溶于盐酸又能溶于氢氧化钠溶液,则甲是Al2O3,乙是Al2(SO4)3,丙是Al(OH)3,甲→乙的反应方程式为:Al2O3+3H2SO4=Al2(SO4)3+3H2O,乙→丙的反应方程式为:Al2(SO4)3+6NH3•H2O=2Al(OH)3↓+3(NH4)2SO4,
故答案为:Al2O3;Al2O3+3H2SO4=Al2(SO4)3+3H2O;Al2(SO4)3+6NH3•H2O=2Al(OH)3↓+3(NH4)2SO4;
(2)若乙溶液中加入KSCN溶液,有血红色出现,则甲是 Fe2O3,乙是Fe2(SO4)3,丙是Fe(OH)3.甲→乙的离子方程式为:Fe2O3+6H+=Fe3++3H2O,乙→丙的离子方程式为:Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+,
故答案为:Fe2O3;Fe2O3+6H+=Fe3++3H2O;Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+.
点评 本题考查无机物推断,涉及Fe、Al元素化合物性质与转化,物质性质是推断突破口,掌握中学常见三角转化关系.

练习册系列答案
 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案
相关题目
9. 科学家用氮化镓材料与铜组装成如图所示的人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4.下列关于该电池叙述错误的是( )
科学家用氮化镓材料与铜组装成如图所示的人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4.下列关于该电池叙述错误的是( )
 科学家用氮化镓材料与铜组装成如图所示的人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4.下列关于该电池叙述错误的是( )
科学家用氮化镓材料与铜组装成如图所示的人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4.下列关于该电池叙述错误的是( )| A. | 电池工作时,是将太阳能转化为电能 | |
| B. | 铜电极为正极,电极反应式为:CO2+8e-+8H+=CH4+2H2O | |
| C. | 电池内部H+透过质子交换膜从左向右移动 | |
| D. | 为提高该人工光合系统的工作效率,可向装置中加入少量盐酸 |
13.下列离子方程式正确的是( )
| A. | 铁与稀硫酸反应:Fe+2H+═Fe3++H2↑ | |
| B. | 氢氧化铝与足量盐酸反应:Al(OH)3+3H+═Al3++3H2O | |
| C. | 钠跟冷水反应:Na+2H2O═Na++2OH-+H2↑ | |
| D. | 铜片与稀硝酸反应:Cu+NO3-+4H+═Cu2++NO↑+2H2O |
3.下列关于气体摩尔体积的叙述正确的是( )
| A. | 1 mol任何气体的体积都为22.4 L | |
| B. | 1 mol任何物质在标准状况下所占的体积都为22.4 L | |
| C. | 标准状况下,1 mol四氯化碳所占的体积是22.4 L | |
| D. | 标准状况下,22.4 L的任何气体的物质的量都是1 mol |
10. 室温下,将0.10mol•L-1盐酸滴入20.00mL 0.10mol•L-1氨水中,溶液中pH和pOH随加入盐酸体积变化曲线如图所示.已知:pOH=-lg c(OH-),下列说法正确的是( )
室温下,将0.10mol•L-1盐酸滴入20.00mL 0.10mol•L-1氨水中,溶液中pH和pOH随加入盐酸体积变化曲线如图所示.已知:pOH=-lg c(OH-),下列说法正确的是( )
 室温下,将0.10mol•L-1盐酸滴入20.00mL 0.10mol•L-1氨水中,溶液中pH和pOH随加入盐酸体积变化曲线如图所示.已知:pOH=-lg c(OH-),下列说法正确的是( )
室温下,将0.10mol•L-1盐酸滴入20.00mL 0.10mol•L-1氨水中,溶液中pH和pOH随加入盐酸体积变化曲线如图所示.已知:pOH=-lg c(OH-),下列说法正确的是( )| A. | M点所示溶液中c(NH4+)+c(NH3•H2O)=c(Cl-) | |
| B. | N点所示溶液中c(NH4+)>c(Cl-) | |
| C. | Q点消耗盐酸的体积等于氨水的体积 | |
| D. | M点和N点所示溶液中水的电离程度相同 |
7.下列各组混合物中,以任意比例混合,只要总质量固定,经充分燃烧后产生CO2的量为一恒定值的是( )
| A. | 甲烷和乙烷 | B. | 乙醇和乙酸 | C. | 丙烯和丙烷 | D. | 乙炔和苯蒸气 |
8.下列说法不正确的是( )
| A. | 化学反应除了生成新物质外,还伴随着能量的变化 | |
| B. | 放热反应不需要加热就能发生 | |
| C. | 吸热反应在一定条件(如常温、加热等)也能发生 | |
| D. | 化学反应是放热还是吸热,取决于反应物和生成物所具有的总能量的相对高低 |
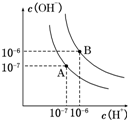 已知水在25℃和95℃时,其电离平衡曲线如图所示:
已知水在25℃和95℃时,其电离平衡曲线如图所示: