题目内容
20.现有A、B、C、D、E五种原子序数依次增大的前四周期元素,A元素原子序数与周期序数相同;B、C同周期左右紧邻且二者能形成多种常见有害于大气的气态化合物;D是所在周期的原子序数最大的金属元素;E处于第四周期且其基态原子价层电子排布式为md2mnsn-2.请回答下列问题(用元素符号或化学式作答):
(1)BA3分子的空间构型为三角锥形,B、C元素的第一电离能大小关系为N>O(或O<N).
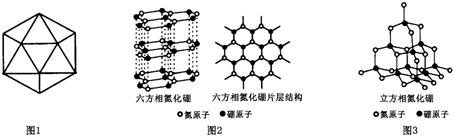
(2)与D元素同族的短周期元素M与B元素形成的某种化合物是具有特殊功能的陶瓷,其晶胞结构如图1,则每个晶胞中含M原子的个数为2,该功能陶瓷的化学式为BN.
(3)A、C两元素形成原子个数比1:1的化合物在酸性条件下能将E2+氧化,写出其离子方程式2Fe2++H2O2+2H+=2Fe3++2H2O.
(4)写出以金属D、E为两电极、NaOH溶液为电解质溶液组成原电池的负极反应式Al-3e-+4OH-=AlO2-+2H2O.
(5)已知在微生物作用的条件下,BA4+经过两步反应被氧化成BC3-.两步反应的能量变化如图2.试写出1mol BA4+(aq)全部氧化成BC3-(aq)的热化学方程式NH4+(aq)+2O2(g)=NO3-(aq)+2H+(aq)+H2O(l)△H=-346kJ/mol.
分析 B、C同周期左右紧邻且二者能形成多种常见有害于大气的气态化合物,B为N元素,C为O元素,可形成氮氧化物,A元素原子序数与周期序数相同,应为H元素,E处于第四周期且其基态原子价层电子排布式为md2mnsn-2.因为前四周期元素,则n=4,m=3,应为Fe元素,D是所在周期的原子序数最大的金属元素,应为第三周期元素,应为Al,
(1)BA3分子为氨气,为三角锥形结构,N的最外层为半充满状态,第一电离能大于O;
(2)与D元素同族的短周期元素M与B元素形成的某种化合物是具有特殊功能的陶瓷应为氮化硼;
(3)反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O;
(4)Al为负极,被氧化生成AlO2-;
(5)由图可知,1mol BA4+(aq)全部氧化成BC3-(aq)共放出的热量为273+73=346(kJ).
解答 解:B、C同周期左右紧邻且二者能形成多种常见有害于大气的气态化合物,B为N元素,C为O元素,可形成氮氧化物,A元素原子序数与周期序数相同,应为H元素,E处于第四周期且其基态原子价层电子排布式为md2mnsn-2.因为前四周期元素,则n=4,m=3,应为Fe元素,D是所在周期的原子序数最大的金属元素,应为第三周期元素,应为Al,
(1)BA3分子为氨气,为三角锥形结构,N的最外层为半充满状态,第一电离能大于O,故答案为:三角锥形;N>O(或O<N);
(2)与D元素同族的短周期元素M与B元素形成的某种化合物是具有特殊功能的陶瓷应为氮化硼,由晶胞可知B原子半径较大,位于定点和体心,数目为1+8×$\frac{1}{8}$=2,
N位于棱和体心,数目为4×$\frac{1}{4}$+1=2,则比值为1:1,化学式为BN,
故答案为:2;BN;
(3)A、C两元素形成原子个数比1:1的化合物在酸性条件下能将E2+氧化,反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O,
故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;
(4)Al为负极,被氧化生成AlO2-,电极方程式为Al-3e-+4OH-=AlO2-+2H2O,故答案为:Al-3e-+4OH-=AlO2-+2H2O;
(5)由图可知,1mol BA4+(aq)全部氧化成BC3-(aq)共放出的热量为273+73=346(kJ),则热化学方程式为NH4+(aq)+2O2(g)=NO3-(aq)+2H+(aq)+H2O(l)△H=-346 kJ/mol,
故答案为:NH4+(aq)+2O2(g)=NO3-(aq)+2H+(aq)+H2O(l)△H=-346 kJ/mol.
点评 本题考查结构性质位置关系应用,为高频考点,推断元素是解题关键,综合考查学生分析能力、逻辑推理能力及对知识的迁移运用,需要学生具备扎实的基础.

| A. | 2种 | B. | 6种 | C. | 7种 | D. | 8种 |
| A. | X氢化物溶于水后,在常温下,该溶液的pH<7 | |
| B. | Y的最高价氧化物的水化物具有两性 | |
| C. | Z离子在水溶液中水解导致其溶液显碱性 | |
| D. | 简单离子的半径:Y>Z>X |
| 错误 | 原因分析及改正 | |
| A | FeBr2溶液中通入少量Cl2的离子方程式: 2Br-+Cl2═Br2+2Cl- | 还原性强弱:Fe2+>Br-; 改正:2Fe2++Cl2=2Fe3++2Cl-. |
| B | 除去CO2中的HCl气体:通过饱合Na2CO3溶液,分离方法:洗气 | “饱合”应为“饱和”,Na2CO3不仅要吸收HCl气体,还要吸收CO2,应改用饱和NaHCO3溶液;分离方法:洗气. |
| C | 用已知浓度的HCl溶液滴定未知浓度的NaOH溶液.指示剂:甲基橙,终点判断:当滴至最后一滴标准液,溶液由黄色变为橙色,即达终点. | 指示剂不能用甲基橙,改用酚酞,终点判断:当滴至最后一滴标准液,溶液由红色变为浅红色,即达终点. |
| D | 双原子分子一定是非极性分子 | 双原子分子有可能为单质或化合物分子; 改正:双原子单质分子一定是非极性分子而双原子化合物分子一定是极性分子. |
| A. | A | B. | B | C. | C | D. | D |
| A. | 溴乙烷 | B. | 天然气 | C. | 石油 | D. | 酒精 |
 科学家用氮化镓材料与铜组装成如图所示的人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4.下列关于该电池叙述错误的是( )
科学家用氮化镓材料与铜组装成如图所示的人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4.下列关于该电池叙述错误的是( )| A. | 电池工作时,是将太阳能转化为电能 | |
| B. | 铜电极为正极,电极反应式为:CO2+8e-+8H+=CH4+2H2O | |
| C. | 电池内部H+透过质子交换膜从左向右移动 | |
| D. | 为提高该人工光合系统的工作效率,可向装置中加入少量盐酸 |
 ,并推测1molNH4BF4(氟硼酸铵)中含有2NA个配位键.
,并推测1molNH4BF4(氟硼酸铵)中含有2NA个配位键.