题目内容
14.工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:CO(g)+2H2(g)?CH3OH(g)△H(1)已知CO(g)、H2(g)的标准燃烧热分别为-285.8kJ•mol-1,-283.0kJ•mol-1,且CH3OH(g)+$\frac{3}{2}$O2(g)?CO2(g)+2H2O(l)△H=-761kJ/mol;则CO(g)+2H2(g)?CH3OH(g)的△H=-90.8 kJ/mol.
(2)若将等物质的量的CO和H2混合气体充入恒温恒容密闭容器中进行上述反应,下列事实能说明此反应已达到平衡状态的是D.
A.容器内气体密度保持不变 B.混合气体的平均相对分子质量不变
C.生成CH3OH的速率与生成H2的速率相等 D.CO的体积分数保持不变
(3)下列措施中既有利于增大该反应的反应速率又能增大CO转化率的是C.
A.将CH3OH及时从混合物中分离
B.降低反应温度
C.恒容装置中充入H2
D.使用高效催化剂
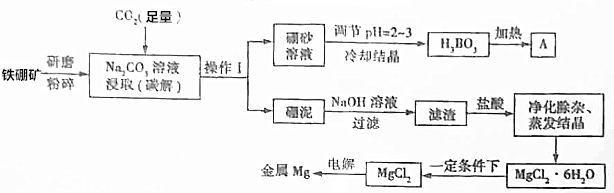
(4)在容积为2L的恒容容器中,分别研究反应在300℃、350℃和400℃三种温度下合成甲醇的规律.图2是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系.请回答:
①在上述三种温度中,曲线X对应的温度是300℃.
②利用图1中a点对应的数据,计算出曲线Z在对应温度下
CO(g)+2H2(g)?CH3OH(g) 的平衡常数K=16.
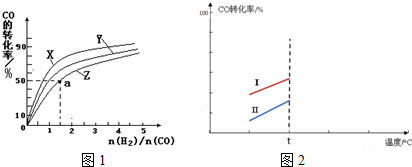
(5)其他条件相同时,某同学研究该甲醇合成反应在不同催化剂Ⅰ或Ⅱ作用下反应相同时间时,CO的转化率随反应温度的变化情况.请在图2中补充t℃后的变化情况.
分析 (1)先根据燃烧热分别写出CO、H2、CH3OH热化学方程式
CO燃烧的热化学方程式:CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-283kJ•mol-1 ①
H2燃烧的热化学方程式:2H2(g)+O2(g)═2H2O(l)△H=-285.8×2 kJ•mol-1 ②
CH3OH燃烧的热化学方程式:CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H=-726.5kJ•mol-1 ③
根据盖斯定律将①+②-③计算;
(2)根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态;
(3)该可逆反应是反应前后气体体积减小的放热反应,增大反应速率又有利于提高CO转化率,应该增大压强;
(4)①合成甲醇的反应是放热反应,温度升高,转化率降低;
②根据平衡常数表达式和一氧化碳的转化率求算;
(5)催化剂可以加快反应速率,但是不会引起化学平衡的移动,升高温度,可以引起化学平衡移动,据此回答.
解答 解:(1)CO燃烧的热化学方程式:CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-283kJ•mol-1 ①
H2燃烧的热化学方程式:2H2(g)+O2(g)═2H2O(l)△H=-285.8×2 kJ•mol-1 ②
CH3OH燃烧的热化学方程式:CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H=-761kJ•mol-1 ③
根据盖斯定律将①+②+(-③)可得:CO(g)+2H2(g)═CH3OH(l)△H=-90.8KJ•mol-1,
故答案为:-90.8 kJ/mol;
(2)A、反应前后质量和体积一直不变,所以密度一直不变,不能判断平衡,故A错误;
B、反应前后质量不变,但物质的量在变,所以平均相对分子质量保持不变,说明反应达平衡状态,故B正确;
C、生成CH3OH的速率与生成H2的速率等于系数之比,才能证明正逆反应速率相等,此时给定的条件不能判断平衡,故C错误;
D、CO体积分数保持不变,说明正逆反应速率相等,则反应达平衡状态,故D正确;
故选D;
(3)该可逆反应是反应前后气体体积减小的放热反应,
A.随时将CH3OH与反应混合物分离,平衡向正反应方向移动,但反应速率不变,故错误;
B.降低反应温度平衡向正反应方向移动,但反应速率减小,故错误;
C.恒容装置中充入H2,即增大体系压强,平衡向正反应方向移动且反应速率增大,故正确;
D.使用高效催化剂,反应速率增大,但平衡不移动,故错误;
故选C;
(4)①根据反应CO(g)+2H2(g)?CH3OH(g)△H1=-116kJ•mol-1,是放热反应,温度越高,转化率越低,所以曲线Z对应的温度是300℃,
故答案是:300℃;
②该反应的平衡常数K=$\frac{c(C{H}_{3}OH)}{c(CO)•{c}^{2}({H}_{2})}$,a点时,CO转化率50%,反应消耗了1mol×50%=0.5molCO,消耗氢气1mol,剩余n(H2)=1.5mol-1mol=0.5mol,生成0.5mol甲醇,a点各组分的浓度是:c(CH3OH)=0.25mol/L,c(CO)=0.25mol/L,c(H2)=0.25mol/L,
带人表达式得:K=$\frac{0.25}{0.25×0.2{5}^{2}}$=16L2•mol-2,
故答案是:16;
(5)催化剂可以加快反应速率,但是不会引起化学平衡的移动,升高温度,化学平衡逆向移动,可以降低CO的转化率,t℃后的变化情况如下: ,故答案为:
,故答案为: .
.
点评 本题考查较综合,涉及原电池原理、化学平衡计算、外界条件对化学平衡的影响等知识点,侧重考查学生分析问题、灵活运用知识解答问题能力题目难度中等.

| A. | 溴乙烷 | B. | 天然气 | C. | 石油 | D. | 酒精 |
| 组号 | 反应温度(℃) | 参加反应的物质 | ||||
| Na2S2O3 | H2SO4 | H2O的体积(mL) | ||||
| 体积(mL) | 浓度(mol•L-1) | 体积(mL) | 浓度(mol•L-1) | |||
| A | 10 | 5.0 | 0.10 | 10.0 | 0.10 | 5.0 |
| B | 10 | 5.0 | 0.10 | 5.0 | 0.10 | 10.0 |
| C | 30 | 5.0 | 0.10 | 5.0 | 0.10 | 10.0 |
| D | 30 | 5.0 | 0.20 | 5.0 | 0.10 | 10.0 |
| A. | A | B. | B | C. | C | D. | D |
 科学家用氮化镓材料与铜组装成如图所示的人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4.下列关于该电池叙述错误的是( )
科学家用氮化镓材料与铜组装成如图所示的人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4.下列关于该电池叙述错误的是( )| A. | 电池工作时,是将太阳能转化为电能 | |
| B. | 铜电极为正极,电极反应式为:CO2+8e-+8H+=CH4+2H2O | |
| C. | 电池内部H+透过质子交换膜从左向右移动 | |
| D. | 为提高该人工光合系统的工作效率,可向装置中加入少量盐酸 |
| A. | a=b=100 | B. | a=b=1000 | C. | a<b | D. | a>b |
| A. | 1 mol任何气体的体积都为22.4 L | |
| B. | 1 mol任何物质在标准状况下所占的体积都为22.4 L | |
| C. | 标准状况下,1 mol四氯化碳所占的体积是22.4 L | |
| D. | 标准状况下,22.4 L的任何气体的物质的量都是1 mol |
 ;
;