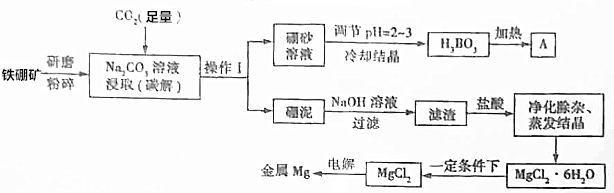
题目内容
18.周期表中的五种元素A、B、D、E、F,原子序数依次增大,A的基态原子价层电子排布为nsnnpn;B的基态原子2p能级有3个单电子;D是一种富集在海水中的元素,含量位于海水中各元素的第三位;E2+的3d轨道中有10个电子;F位于第六周期,与Cu同族,其单质在金属活动性顺序表中排在末位.(1)写出E的基态原子的价层电子排布式3d104s2
(2)A、B形成的AB-常作为配位化合物中的配体,其A原子的杂化方式为sp,AB-中含有的σ键与π键的数目之比为1:2
(3)FD3是一种褐红色晶体,吸湿性极强,易溶于水和乙醇,无论是固态、还是气态,它都是以二聚体F2D6的形式存在,依据以上信息判断FD3,晶体的结构属于分子晶体,写出F2D6的结构式
 .
.
分析 周期表中的五种元素A、B、D、E、F,原子序数依次增大,A的基态原子价层电子排布为nsnnpn,s能级容纳2个电子,则n=2,故A为碳元素;B的基态原子2p能级有3个单电子,价层电子排布为2s22p3,则B为N元素;D是一种富集在海水中的元素,含量位于海水中各元素的第三位,则D为Cl;E2+的3d轨道中有10个电子,则E原子核外电子数为2+8+18+2=30,故E为Zn;F位于第六周期,与Cu同族,其单质在金属活动性顺序表中排在末位,则F为Au.
解答 解:周期表中的五种元素A、B、D、E、F,原子序数依次增大,A的基态原子价层电子排布为nsnnpn,s能级容纳2个电子,则n=2,故A为碳元素;B的基态原子2p能级有3个单电子,价层电子排布为2s22p3,则B为N元素;D是一种富集在海水中的元素,含量位于海水中各元素的第三位,则D为Cl;E2+的3d轨道中有10个电子,则E原子核外电子数为2+8+18+2=30,故E为Zn;F位于第六周期,与Cu同族,其单质在金属活动性顺序表中排在末位,则F为Au.
(1)E2+的3d轨道中有10个电子,则E基态原子的价层电子排布式3d104s2,
故答案为:3d104s2;
(2)A、B形成的CN-常作为配位化合物中的配体,CN-中C原子杂化轨道数目为1+$\frac{4+1-3}{2}$=2,C原子杂化方式为 sp杂化,CN-与氮气互为等电子体,C原子与N原子之间形成C≡N三键,含有的σ键与π键的数目之比为 1:2,
故答案为:sp;1:2;
(3)AuCl3是一种褐红色晶体,吸湿性极强,易溶于水和乙醇,无论是固态、还是气态,它都是以二聚体Au2Cl6的形式存在,依据以上信息判断AuCl3晶体的结构属于分子晶体,Au2Cl6的结构式为: ,
,
故答案为:分子; .
.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、杂化方式、化学键、晶体类型与性质、分子结构等,(3)中问题基本不是中学内容,为易错点、难点.

| A. | X氢化物溶于水后,在常温下,该溶液的pH<7 | |
| B. | Y的最高价氧化物的水化物具有两性 | |
| C. | Z离子在水溶液中水解导致其溶液显碱性 | |
| D. | 简单离子的半径:Y>Z>X |
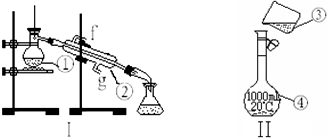
 科学家用氮化镓材料与铜组装成如图所示的人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4.下列关于该电池叙述错误的是( )
科学家用氮化镓材料与铜组装成如图所示的人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4.下列关于该电池叙述错误的是( )| A. | 电池工作时,是将太阳能转化为电能 | |
| B. | 铜电极为正极,电极反应式为:CO2+8e-+8H+=CH4+2H2O | |
| C. | 电池内部H+透过质子交换膜从左向右移动 | |
| D. | 为提高该人工光合系统的工作效率,可向装置中加入少量盐酸 |
| A. | KSCN溶液、氯水 | B. | 稀盐酸、KMnO4溶液 | ||
| C. | 稀硫酸、KMnO4溶液 | D. | NaOH溶液 |
| A. | a=b=100 | B. | a=b=1000 | C. | a<b | D. | a>b |
| A. | 甲烷和乙烷 | B. | 乙醇和乙酸 | C. | 丙烯和丙烷 | D. | 乙炔和苯蒸气 |
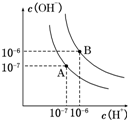 已知水在25℃和95℃时,其电离平衡曲线如图所示:
已知水在25℃和95℃时,其电离平衡曲线如图所示: