题目内容
5.今年3月,Google公司研发的智能计算机AlphaGo以四比一的战绩完胜世界棋王李世石.AlphaGo的制造工艺中涉及很多化学知识:(1)AlphaGo的核心--中央处理器(CPU)的主要成分是高纯硅单晶.在提纯粗硅的流程中硅元素被还原一步的化学方程式为SiCl4+2H2=Si+4HCl.
(2)AlphaGo集成电路板的印刷过程中常利用的离子反应为Cu+2Fe3+=2Fe2++Cu2+.
(3)AlphaGo的金属外壳主要成分是铝合金,合金中的铝在空气中不易被腐蚀,十分稳定的原因有bc(填字母序号).
a.铝不与空气中的O2、H2O等物质反应
b.铝金属的表面存在一层致密的氧化膜
c.铝合金中可能掺有一些活泼金属,如Mg-Al合金.
分析 (1)在提纯粗硅的流程中硅元素被还原一步为四氯化硅与氢气反应生成硅与氯化氢;
(2)铜与三价铁离子发生氧化还原反应生成二价铁离子和铜离子;
(3)铝性质活泼,能够与空气中氧气发生反应生成氧化铝,生成一层致密氧化膜,阻止铝与空气接触,铝镁形成合金也能与氧气反应生成氧化膜阻止反应进行.
解答 解:I.(1)在提纯粗硅的流程中硅元素被还原一步为四氯化硅与氢气反应生成硅与氯化氢,化学方程式:SiCl4+2H2=Si+4HCl;
故答案为:SiCl4+2H2=Si+4HCl;
(2)铜与三价铁离子发生氧化还原反应生成二价铁离子和铜离子,离子方程式:Cu+2Fe3+=2Fe2++Cu2+;
故答案为:Cu+2Fe3+=2Fe2++Cu2+;
(3)铝性质活泼,能够与空气中氧气发生反应生成氧化铝,生成一层致密氧化膜,阻止铝与空气接触,铝镁形成合金也能与氧气反应生成氧化膜阻止反应进行,所以合金中的铝在空气中不易被腐蚀;
a.铝性质活泼,能够与空气中氧气发生反应,故a不选;
b.铝金属的表面存在一层致密的氧化膜氧化铝,氧化铝能阻止氧气与铝接触,防止腐蚀,故b选;
c.铝镁形成合金也能与氧气反应生成氧化镁、氧化铝氧化膜阻止反应进行,能够防止腐蚀,故c选;
故选:bc.
点评 本题考查了方程式、离子方程式的书写,铝及合金的性质,明确反应实质及铝的性质是解题关键,题目难度不大.

练习册系列答案
相关题目
15.多晶硅是太阳能光伏产业的基础材料.制备多晶硅必须先得到高纯硅.三氯甲硅烷(SiHCl3)是一种可燃,易与水反应的气体,当前制备高纯硅的主要方法是在一定条件下以三氯甲硅烷为原料用氢气还原,其生产流程如图所示:

(1)①流化床反应器中主要反应的化学方程式是Si+3HCl$\frac{\underline{\;高温\;}}{\;}$SiHCl3+H2,
在生成的产物中,SiHCl3大约占85%,还有SiCl4、SiH2Cl2、SiH3Cl等,提纯SiHCl3的主要工艺操作依次是沉降、冷凝和精馏.
②整个制备过程中必须保证无水无氧.SiHCl3遇H2O剧烈反应生成H2SiO3、HCl和另一种物质,写出该反应的化学方程式:SiHCl3+3H2O═H2SiO3↓+3HCl↑+H2↑.
③H2还原SiHCl3过程中若混入O2,可能引起的后果是O2与SiHCl3、H2混合可能引起爆炸.
(2)该工艺流程可循环利用的物质是H2和HCl.
(3)Na2SiO3的水溶液俗称水玻璃,用水玻璃可制得高纯度SiO2.取少量水玻璃于试管中,逐滴加入饱和NH4Cl溶液,振荡.观察到的实验现象是试管中有白色胶状沉淀生成,有刺激性气味气体生成.
(4)电弧炉中制得的粗硅中含有副产物SiC,已知其中Si和SiC的物质的量之比为2:1,
制取粗硅时的化学方程式是3SiO2+7C═2Si+SiC+6CO↑,
若在反应中生成了2.8g Si,则转移电子数为0.6NA或3.612×1023.

| 物质 | Si | SiCl4 | SiHCl3 | SiH2Cl2 | SiH3Cl | HCl | SiH4 |
| 沸点/℃ | 2 355 | 57.6 | 31.8 | 8.2 | -30.4 | -84.9 | -111.9 |
在生成的产物中,SiHCl3大约占85%,还有SiCl4、SiH2Cl2、SiH3Cl等,提纯SiHCl3的主要工艺操作依次是沉降、冷凝和精馏.
②整个制备过程中必须保证无水无氧.SiHCl3遇H2O剧烈反应生成H2SiO3、HCl和另一种物质,写出该反应的化学方程式:SiHCl3+3H2O═H2SiO3↓+3HCl↑+H2↑.
③H2还原SiHCl3过程中若混入O2,可能引起的后果是O2与SiHCl3、H2混合可能引起爆炸.
(2)该工艺流程可循环利用的物质是H2和HCl.
(3)Na2SiO3的水溶液俗称水玻璃,用水玻璃可制得高纯度SiO2.取少量水玻璃于试管中,逐滴加入饱和NH4Cl溶液,振荡.观察到的实验现象是试管中有白色胶状沉淀生成,有刺激性气味气体生成.
(4)电弧炉中制得的粗硅中含有副产物SiC,已知其中Si和SiC的物质的量之比为2:1,
制取粗硅时的化学方程式是3SiO2+7C═2Si+SiC+6CO↑,
若在反应中生成了2.8g Si,则转移电子数为0.6NA或3.612×1023.
16.某有机物的结构简式如图所示,下列有关该有机物的说法正确的是( )
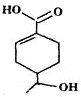

| A. | 分子中含有四种官能团 | |
| B. | 1mol该有机物完全燃烧消耗O2的物质的量为10mol | |
| C. | 能发生加成、取代、消去、水解等反应 | |
| D. | 相同条件下,等量的该有机物分别与足量的Na和NaHCO3溶液反应产生的气体的量相同 |
20.下列说法中不正确的是( )
| A. | 宇宙星体、地球内部都处于高压状态,探究“高压下钠和锂单质金属→绝缘体转变”现象的本质、理解处于高压状态下一些物质的行为具有重要意义,它们可以为研究星体和地球内部构造提供理论支持 | |
| B. | 工业、农业以及日常生活中产生的污水应当分开处理.常用的污水处理方法有中和法、氧化还原法、离子交换法、萃取法、吹脱法、吸附法、电渗析法等,其中前三种属于化学处理方法 | |
| C. | 新型炸药--C4塑胶炸药得名于其空间网状延展结构的每个结构基元含有4个碳原子,由于该炸药成体时无需包裹金属外壳及添加金属芯件,因此能轻易躲过普通X光安全检查,具有较强的隐蔽性 | |
| D. | 建筑领域常使用的黏土、石英、白垩石和多用于农业和食品工业的硅藻土、硅胶均不属于硅酸盐材料的范畴 |
10.下列叙述正确的是( )
| A. | 乙二醇和丙三醇互为同系物 | |
| B. | 不同元素的原子构成的分子只含极性共价键 | |
| C. | ${\;}_{92}^{235}$U和${\;}_{92}^{238}$U是中子数不同质子数相同的同种核素 | |
| D. | 短周期第ⅣA与ⅦA族元素的原子间构成的分子,均满足原子最外层8电子结构 |
17.有a、b、c、d四种元素,均为原子序数依次增大的前20号元素.a存在a+和a-两种 离子,b和c为同一主族元素,c的次外层有8个电子,c2-和d2+的电子层结构相同.下列叙述正确的是( )
| A. | b、c与a形成化合物的稳定性一定为c>b | |
| B. | a和d形成的化合物与水反应产生气体可以作燃料 | |
| C. | c、a和b可形成的化合物为离子化合物 | |
| D. | a、b、c、d四种元素组成的化合物的水溶液可以为酸性、也可以为碱性 |
14.自制胶水的方法之一是将废旧高分子材料切碎后用汽油浸泡-段时间,待其溶解后,即可作胶水使用.下列材料可作该项用途的是( )
| A. | 硫化橡胶 | B. | 酚醛树脂 | C. | 聚乙烯塑料 | D. | 硝酸纤维 |
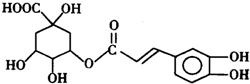 .
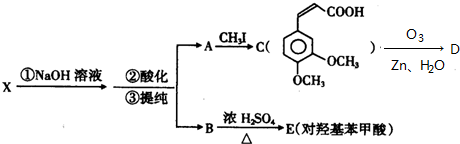
.
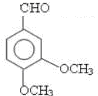 ;
;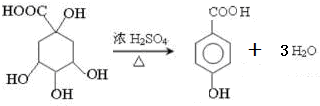 ;
;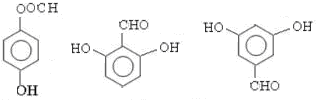 任意一种;(任写一种)
任意一种;(任写一种)