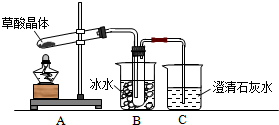
题目内容
10.下列叙述正确的是( )| A. | 乙二醇和丙三醇互为同系物 | |
| B. | 不同元素的原子构成的分子只含极性共价键 | |
| C. | ${\;}_{92}^{235}$U和${\;}_{92}^{238}$U是中子数不同质子数相同的同种核素 | |
| D. | 短周期第ⅣA与ⅦA族元素的原子间构成的分子,均满足原子最外层8电子结构 |
分析 A、乙二醇与丙三醇中含有的官能团羟基的数目不同,二者结构不同;
B、H、O形成的化合物中能存在非极性共价键;
C、核素的种类由质子数和中子数决定,质子数相同中子数不同的同一元素互称同位素;
D、短周期第ⅣA与ⅦA族元素的原子间构成的分子,化合物为XY4型,共价键数+原子最外层电子数=8满足8电子.
解答 解:A、同系物必须具有相似结构,乙二醇含有2个羟基,丙三醇含有3个羟基,二者结构不同,一定不属于同系物,故A错误;
B、H、O形成的化合物中能存在非极性共价键,如过氧化氢中存在极性键和非极性共价键,故B错误;
C、23592U和23892U是同种元素的不同核素,质子数相同,中子数不同,互为同位素,故C错误;
D、ⅣA(用X表示)与ⅦA(用Y表示)形成的化合物为XY4,X形成四个键,加上原来的4个电子,最外层共8个电子,每个Y形成一个键,加上原来的7个电子,共8个电子,故D正确.
故选D.
点评 本题考查核素、分子结构、原子结构与元素性质关系等,难度不大,注意基础知识的掌握.

练习册系列答案
相关题目
2.下列有关物质的性质和应用都正确的是( )
| A. | BaSO4的水溶液不导电,故BaSO4是弱电解质 | |
| B. | 甲烷、甲醛、甲酸都不存在同分异构体,则甲醚(CH3OCH3)也不存在同分异构体 | |
| C. | 反应2Mg(s)+CO2(g)═C(s)+2MgO(s)能自发进行,则该反应的△H>0 | |
| D. | AgCl在同温、同浓度的CaCl2和NaCl溶液中的溶解度不同 |
19.下列物质在室温下的溶解度最小的是( )
| A. | 硫酸铵 | B. | 绿矾 | C. | 摩尔盐 | D. | 硫酸 |
3.下列关于物质的检验说法不正确的是( )
| A. | 向某物质中滴加盐酸后,有能使澄清石灰水变浑浊的无色无味气体产生,证明含CO32- | |
| B. | 将某化合物进行焰色实验,透过蓝色钴玻璃观察,焰色为紫色,证明含钾 | |
| C. | 待检液逐滴加入NaOH溶液,有白色胶状沉淀产生,后来沉淀逐渐消失,则原溶液中可能含有Al3+ | |
| D. | 待检液中先加入KSCN溶液,无明显现象,再加入氯水,溶液显血红色,则待检液中一定含有Fe2+ |
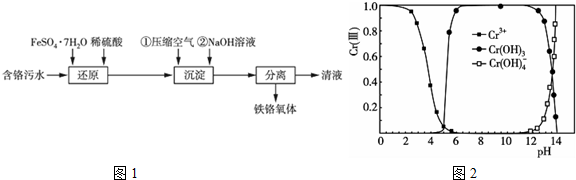
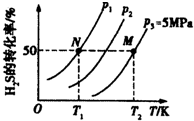 氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点.
氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点.