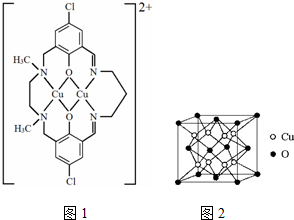
题目内容
16.某学生用标准的0.2mol/L的盐酸滴定待测的NaOH溶液,其实验操作如下:A.用碱式滴定管取待测液NaOH溶液放入锥形瓶,滴加2-3滴酚酞指示剂.
B.用待测的NaOH溶液润洗碱式滴定管.
C.检查滴定管是否漏水.
D.取下酸式滴定管,用标准的盐酸溶液润洗后,再将标准的盐酸注入酸式滴定管至刻度“0”以上2cm-3cm处,把酸式滴定管固定好,调节液面.
E.把滴定管用蒸镏水洗净,并分别固定在滴定管架两边.
F.另取锥形瓶,再重复滴定操作一次.
G.把锥形瓶放在酸式滴定管的下面,瓶下垫一张白纸,然后边滴定边摇动锥形瓶,直至终点,记下滴定管的液面所在刻度.
据上述滴定操作,完成下列填空:
①滴定操作的正确操作顺序是(用上述各编号字母填写)
C→E→D→B→A→G→F;
②G步操作中判断滴定终点的依据是当滴加最后一滴盐酸时,溶液由红色变为无色,且半分钟内不褪色;
③D步骤的操作中液面应调节到0或0刻度一下某一刻度,尖嘴部分应充满液体;
④酸式滴定管未用标准的盐酸润洗,待测溶液NaOH的测定值会偏高;碱式滴定管未用待测的
NaOH溶液润洗,待测NaOH溶液的测定值会偏低.(填“偏高”、“偏低”或“无 影响”.)
分析 ①中和滴定有检漏、洗涤、润洗、装液、取待测液于锥形瓶,然后加入指示剂进行滴定等操作;
②如溶液颜色变化且半分钟内不变色,可说明达到滴定终点;
③滴定管0刻度在上,滴定前应调节到零刻度或零稍下的某一刻度,为减小误差,尖嘴部分应充满液体,无气泡;
④根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析不当操作对V(标准)的影响,以此判断浓度的误差.
解答 解:①操作的步骤是选择滴定管检漏(C),然后洗涤(E)、装液(D)、使尖嘴充满溶液、固定在滴定台上,然后调节液面记下读数.用待测的NaOH溶液润洗碱式滴定管(B).再取待测液于锥形瓶(A),然后加入指示剂进行滴定(G),另取锥形瓶,再重复滴定操作一次(F),所以顺序为:C→E→D→B→A→G→F,
故答案为:C;D;A;G;F;
②本实验是用盐酸滴定NaOH溶液,用酚酞作指示剂,所以终点时,现象是当滴加最后一滴盐酸时,溶液由红色变为无色,且半分钟内不褪色,
故答案为:当滴加最后一滴盐酸时,溶液由红色变为无色,且半分钟内不褪色;
③滴定管0刻度在上,滴定前应调节到零刻度或零稍下的某一刻度,为减小误差,尖嘴部分应充满液体,无气泡,
故答案为:0或0刻度一下某一刻度;充满液体;
④酸式滴定管未用标准盐酸润洗就直接注入标准盐酸,盐酸被稀释,浓度降低,造成V(标准)偏大,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析可知c(待测)偏高,
碱式滴定管未用待测的NaOH溶液润洗,待测NaOH溶液被稀释,造成V(待测)偏大,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析可知c(待测)偏低,
故答案为:偏高;偏低.
点评 本题综合考查酸碱中和滴定,侧重于化学实验基本操作以及物质的含量的测定等问题,题目难度不大,在学习中注意把握相关基本实验方法,注意根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$进行误差分析.

| A. | “歼-20”飞机上使用的碳纤维是一种新型的有机高分子材料 | |
| B. | 用活性炭为糖浆脱色和用臭氧漂白纸浆,原理相似 | |
| C. | 燃料电池的燃料都在负极发生氧化反应 | |
| D. | Fe3O4俗称铁红,常做红色油漆和涂料 |
| 选项 | ① | ② | ③ | 实验结论 |  |
| A | 浓醋酸 | 石灰石 | Na2SiO3溶液 | 酸性:醋酸>碳酸>硅酸 | |
| B | 浓盐酸 | KMnO4 | KBr溶液 | 氧化性:KMnO4>Cl2>Br2 | |
| C | 稀硫酸 | FeS | SO2水溶液 | BaS可还原SO2 | |
| D | 盐浓酸 | 浓硫酸 | BaSO3悬浊液 | BaSO3可溶于盐酸 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 反应中氧化剂和还原剂的质量比为1:2 | |
| B. | 反应中生成了8g Cu2S | |
| C. | 反应中有0.2×6.02×1023个电子转移 | |
| D. | 反应中有1.6g硫被氧化 |
 如图为两套实验装置.
如图为两套实验装置.
 实验室需要0.1mol/LNaOH溶液450mL和0.5mol/L的硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题.
实验室需要0.1mol/LNaOH溶液450mL和0.5mol/L的硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题. 实验室需要0.1mol•L-1NaOH溶液480mL.
实验室需要0.1mol•L-1NaOH溶液480mL.