题目内容
11.氯气溶于水发生反应,写出其化学方程式Cl2+H2O═HCl+HClO.某学生为了探究氯水的成分,请你与他一起完成探究过程,并书写实验报告.
| 实验步骤 | 操作方法 | 实验现象 | 结论或解释 |
| 1 | 观察氯水的颜色 | 含有Cl2 | |
| 2 | 有无色气体产生 | 含有H+ | |
| 3 | 取少量氯水于试管中,加入稀硝酸酸化的硝酸银溶液 | 有白色沉淀生成 | |
| 4 | 取少量氯水于试管中,放入红色布条 |
分析 氯气溶于水与水反应生成氯化氢和次氯酸;
氯气为黄绿色气体,氯化氢溶于水生成盐酸,盐酸能够与铁粉反应生成氢气,氯离子能够与硝酸银反应生成氯化银沉淀,次氯酸具有漂白性,能够使有色物质褪色,据此分析判断.
解答 解:氯气溶于水与水反应生成氯化氢和次氯酸,化学方程式:Cl2+H2O═HCl+HClO;
氯气为黄绿色气体,观察氯水的颜色,溶液呈黄绿色,说明含有氯气;
氯化氢溶于水生成盐酸,盐酸能够与铁粉反应生成氢气,所以少量氯水加入盛有铁粉的试管,有无色气体生成,证明氢离子存在;
氯离子能够与硝酸银反应生成氯化银沉淀,所以取少量氯水于试管中,加入稀硝酸酸化的硝酸银溶液,产白色沉淀,证明氯离子存在;
次氯酸具有漂白性,能够使有色物质褪色,取少量氯水于试管中,放入红色布条,红色布条褪色,证明含有次氯酸,
故答案为:Cl2+H2O═HCl+HClO;
| 实验步骤 | 操作方法 | 实验现象 | 结论或解释 |
| 1 | 溶液呈黄绿色 | ||
| 2 | 少量氯水加入盛有铁粉的试管 | ||
| 3 | 含有Cl- | ||
| 4 | 红色布条褪色 | 含有HClO |
点评 本题考查了实验方案的设计,明确氯气的成分及性质是解题关键,题目难度中等.

练习册系列答案
 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案
相关题目
1.下列分子中所有原子都满足最外层为8电子结构的是( )
①BeCl2 ②NCl3 ③PCl5 ④COCl2 ⑤SF6 ⑥XeF2 ⑦CS2 ⑧CH4 ⑨CF2Cl2.
①BeCl2 ②NCl3 ③PCl5 ④COCl2 ⑤SF6 ⑥XeF2 ⑦CS2 ⑧CH4 ⑨CF2Cl2.
| A. | ②④⑦⑧⑨ | B. | ②④⑦⑨ | C. | ③④⑦ | D. | ④⑤⑦⑨ |
2.若某共价化合物中含有C、H、O、N四种元素,且以n(C)、n(N)、n(O)分别表示C、N、O的原子数目,则H原子数目最多等于( )
| A. | 2n(C)+n(N)+2 | B. | 2n(C)+2n(N)+n(O) | C. | 3n(C)+2n(O)+2 | D. | 2n(C)+2n(N)+2 |
19.在一密封容器中盛有0.8mol Na2O2与1mol NaHCO3,将其加热到3000C,经充分反应后,容器内残留的固体是( )
| A. | 0.5mol Na2CO3和1.6mol NaOH | B. | 1mol Na2CO3与0.6mol NaHCO3 | ||
| C. | 0.8mol Na2CO3和1mol NaOH | D. | 1mol Na2CO3和0.6mol NaOH |
6.下列是某同学对相应反应的离子方程式所作的评价,其中评价完全合理的是( )
| 编号 | 化学反应 | 离子方程式 | 评价 |
| A | Cu和AgNO3溶液反应 | Cu+Ag+═Cu2++Ag | 正确 |
| B | 氧化铝与NaOH溶液反应 | 2Al3++3O2-+2OH-═2AlO2-+H2O | 错误,Al2O3不应写成离子形式 |
| C | Fe和稀硫酸反应 | 2Fe+6H+═2Fe3++3H2↑ | 正确 |
| D | 钠与硫酸铜溶液反应 | 2Na+Cu2+═Cu+2Na+ | 错误,CuSO4不应写成离子形式 |
| A. | A | B. | B | C. | C | D. | D |
16.一定温度下,在一密闭容器中加入1molPCl5,发生反应PCl5(g)?PCl3(g)+Cl2 (g)充分反应平衡后,测得PCl5的分解率为a%,此时,再向密闭容器中加入1mol PCl5,充分反应,再次平衡后,下列有关说法正确的是( )
| A. | PCl5的分解率大于a% | |
| B. | PCl5的分解率小于a% | |
| C. | 达到平衡后正逆反应速率比原平衡状态时大 | |
| D. | 达到平衡后正逆反应速率比原平衡状态时小 |
3.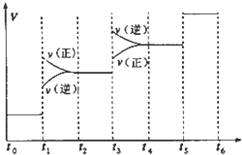 氢气是合成氨的重要原料,合成氨反应的热化方程式如下:
氢气是合成氨的重要原料,合成氨反应的热化方程式如下:
N2(g)+3H2(g)?2NH3(g);△H=-92.4kJ•mol-1
当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如图所示.下列说法正确的是( )
 氢气是合成氨的重要原料,合成氨反应的热化方程式如下:
氢气是合成氨的重要原料,合成氨反应的热化方程式如下:N2(g)+3H2(g)?2NH3(g);△H=-92.4kJ•mol-1
当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如图所示.下列说法正确的是( )
| A. | 图中t1时引起平衡移动的条件可能是升高温度 | |
| B. | 表示平衡混合物中NH3的含量最高的一段时间是t5~t6 | |
| C. | 温度为T℃时,将2amolH2和amolN2放入0.5L密闭容器中,充分反应后测得N2的转化率为50%.则反应的平衡常数为$\frac{16}{{a}_{2}}$ | |
| D. | 在t2~t3时间段,保持容器体积不变,充入一定量的惰性气体,N2的浓度不变 |
8. 甲溶液中含Aa+离子浓度为0.10mol/L,乙溶液含Bb-离子浓度为0.35mol/L,取不同体积甲、乙两溶液的物质的量如图所示.则沉淀物的化学式为( )
甲溶液中含Aa+离子浓度为0.10mol/L,乙溶液含Bb-离子浓度为0.35mol/L,取不同体积甲、乙两溶液的物质的量如图所示.则沉淀物的化学式为( )
 甲溶液中含Aa+离子浓度为0.10mol/L,乙溶液含Bb-离子浓度为0.35mol/L,取不同体积甲、乙两溶液的物质的量如图所示.则沉淀物的化学式为( )
甲溶液中含Aa+离子浓度为0.10mol/L,乙溶液含Bb-离子浓度为0.35mol/L,取不同体积甲、乙两溶液的物质的量如图所示.则沉淀物的化学式为( )| A. | A2B3 | B. | A3B2 | C. | AB2 | D. | A2 |
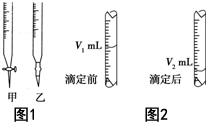 现用物质的量浓度为a mol•L-1的标准NaOH溶液去滴定V mL盐酸的物质的量浓度,请填写下列空白:
现用物质的量浓度为a mol•L-1的标准NaOH溶液去滴定V mL盐酸的物质的量浓度,请填写下列空白: