题目内容
19.在一密封容器中盛有0.8mol Na2O2与1mol NaHCO3,将其加热到3000C,经充分反应后,容器内残留的固体是( )| A. | 0.5mol Na2CO3和1.6mol NaOH | B. | 1mol Na2CO3与0.6mol NaHCO3 | ||
| C. | 0.8mol Na2CO3和1mol NaOH | D. | 1mol Na2CO3和0.6mol NaOH |
分析 加热时碳酸氢钠分解生成二氧化碳和水,分别与过氧化钠反应生成碳酸钠和氢氧化钠,当碳酸氢钠过量时,生成二氧化碳过量,最终产物为碳酸钠.
解答 解:NaHCO3加热分解:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O可知:1mol NaHCO3分解生成0.5mol的二氧化碳、0.5mol的水和0.5molNa2CO3,生成的CO2和H2O分别与Na2O2反应:2Na2O2+2CO2=2Na2CO3+O2,2Na2O2+2H2O=4NaOH+O2↑,二氧化碳首先与过氧化钠反应,消耗过氧化钠0.5mol,生成碳酸钠0.5mol,还有0.3mol的过氧化钠与水反应,生成0.6mol NaOH,所以容器内残留的固体是1mol Na2CO3和0.6mol NaOH,故选D.
点评 本题考查钠的化合物的性质,题目难度不大,本题注意NaHCO3足量的特点,注意有关反应,以正确判断最终产物.

练习册系列答案
相关题目
10.下列有关阿伏加德罗常数NA的说法正确的是( )
| A. | 100mL12mol/L浓盐酸与足量的MnO2加热充分反应生成氯气分子数为0.3 NA | |
| B. | 5.6 g铁粉与硝酸反应失去的电子数一定为0.3NA | |
| C. | 向FeI2溶液中通入适量Cl2,当有1 mol Fe2+被氧化时,共转移的电子的数目为NA | |
| D. | 5.4g铝粉与足量的氢氧化钠溶液充分反应生成氢气分子数为0.3 NA |
7.下列选项表示物质结构的化学用语或模型正确的是( )
| A. | 甲烷分子的比例模型: | B. | 乙烯的结构简式:CH2CH2 | ||
| C. | 醛基的电子式: | D. | 甲醛的结构式: |
14.实验室用少量的溴和足量的乙醇、浓硫酸制备1,2-二溴乙烷的装置如图所示,其中可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚.
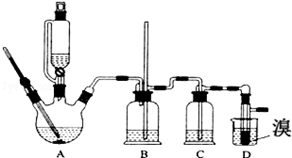
有关数据列表如下:
回答下列问题:
(1)写出装置A中的反应方程式为:C2H5OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O.
(2)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是减少副产物乙醚生成;同时在装置C中应加入NaOH溶液.其目的是吸收反应中可能生成的酸性气体.
(3)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在下层(填“上”、“下”);若产物中有少量未反应的Br2,可用NaOH溶液洗涤除去.
(4)反应过程中应用冷水冷却装置D,但又不能过度冷却(如用冰水),其原因是如果用冰水冷却会使产品凝固而堵塞导管.

有关数据列表如下:
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | 一l30 | 9 | -1l6 |
(1)写出装置A中的反应方程式为:C2H5OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O.
(2)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是减少副产物乙醚生成;同时在装置C中应加入NaOH溶液.其目的是吸收反应中可能生成的酸性气体.
(3)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在下层(填“上”、“下”);若产物中有少量未反应的Br2,可用NaOH溶液洗涤除去.
(4)反应过程中应用冷水冷却装置D,但又不能过度冷却(如用冰水),其原因是如果用冰水冷却会使产品凝固而堵塞导管.
4.将过量的气体通入到一种溶液中,一定能产生沉淀的是( )
①二氧化硫通入到硝酸钡溶液中
②二氧化碳通入到偏铝酸钠溶液中
③二氧化碳通入到氯化钙溶液中
④氨气通入到氯化镁溶液中.
①二氧化硫通入到硝酸钡溶液中
②二氧化碳通入到偏铝酸钠溶液中
③二氧化碳通入到氯化钙溶液中
④氨气通入到氯化镁溶液中.
| A. | 只有①②③ | B. | 只有①② | C. | 只有②③ | D. | 只有①②④ |
11.氯气溶于水发生反应,写出其化学方程式Cl2+H2O═HCl+HClO.
某学生为了探究氯水的成分,请你与他一起完成探究过程,并书写实验报告.
某学生为了探究氯水的成分,请你与他一起完成探究过程,并书写实验报告.
| 实验步骤 | 操作方法 | 实验现象 | 结论或解释 |
| 1 | 观察氯水的颜色 | 含有Cl2 | |
| 2 | 有无色气体产生 | 含有H+ | |
| 3 | 取少量氯水于试管中,加入稀硝酸酸化的硝酸银溶液 | 有白色沉淀生成 | |
| 4 | 取少量氯水于试管中,放入红色布条 |
8.硫铁矿(主要成分为FeS2)在空气中高温煅烧可得SO2和Fe2O3,是我国硫酸工业的主要原料.某化学研究小组拟在实验室利用硫铁矿煅烧所得残渣(主要成分为Fe2O3,还含少量的SiO2,Al2O3,其余杂质不参予反应),制取颜料铁红(Fe2O3).设计工艺流程如下: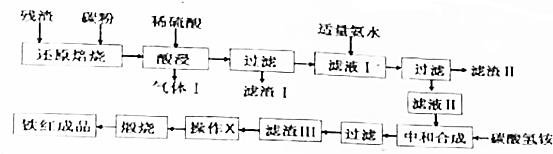
查阅资料:
Ⅰ部分金属离子发生沉淀的pH:
Ⅱ“中和合成”时发生的主要反应为:Fe2++2HCO3-=FeCO3↓+CO2↑+H2O.
请根据以上工艺流程及提供的信息,回答下列问题:
(1)气体Ⅰ的主要成分为H2(填化学式,下同);滤渣Ⅱ的主要成分为Al(OH)3、Fe(OH)3.
(2)操作X为洗涤(填操作名称).
(3)向滤液Ⅰ中加入适量氨水,其目的是调节溶液的pH到5.4~7.5之间.
(4)在“酸浸”过程中,若在空气中“酸浸”时间过长,溶液中Fe2+含量将下降,其原因是(用离子方程式表示):4Fe2++O2+4H+═4Fe3++2H2O.
(5)为测定滤液Ⅰ中的Fe2+的含量,实验室中常用酸性高锰酸钾溶液进行滴定,该反应的离子方程式为:MnO4-+5Fe2++8H+═Mn2++5Fe3++4H2O;取20.00mL滤液Ⅰ于锥形瓶中,用0.1mol/L酸性高锰酸钾溶液滴定到终点时消耗了标准酸性高锰酸钾溶液12.00mL,则滤液Ⅰ中c(Fe2+)=0.3mol/L.

查阅资料:
Ⅰ部分金属离子发生沉淀的pH:
| 金属离子 | Fe3+ | Al3+ | Fe2+ |
| 开始沉淀的pH | 2.2 | 3.1 | 7.5 |
| 完全沉淀的pH | 3.5 | 5.4 | 9.5 |
请根据以上工艺流程及提供的信息,回答下列问题:
(1)气体Ⅰ的主要成分为H2(填化学式,下同);滤渣Ⅱ的主要成分为Al(OH)3、Fe(OH)3.
(2)操作X为洗涤(填操作名称).
(3)向滤液Ⅰ中加入适量氨水,其目的是调节溶液的pH到5.4~7.5之间.
(4)在“酸浸”过程中,若在空气中“酸浸”时间过长,溶液中Fe2+含量将下降,其原因是(用离子方程式表示):4Fe2++O2+4H+═4Fe3++2H2O.
(5)为测定滤液Ⅰ中的Fe2+的含量,实验室中常用酸性高锰酸钾溶液进行滴定,该反应的离子方程式为:MnO4-+5Fe2++8H+═Mn2++5Fe3++4H2O;取20.00mL滤液Ⅰ于锥形瓶中,用0.1mol/L酸性高锰酸钾溶液滴定到终点时消耗了标准酸性高锰酸钾溶液12.00mL,则滤液Ⅰ中c(Fe2+)=0.3mol/L.
16.下列离子方程式中,不正确的是( )
| A. | 将溶质物质的量之比为 2:7 的三氯化铝溶液和氢氧化钡溶液混合:2Al3++7OH-═Al(OH)3↓+AlO2-+2H2O | |
| B. | 澄清石灰水与少量小苏打溶液混合:Ca2++OH-+HCO3-═CaCO3↓+H2O | |
| C. | 向硫酸氢钠溶液中滴加 Ba(OH)2 至中性:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O | |
| D. | 敞开体系,向FeCl2 溶液滴加NaOH 溶液:4Fe2++8OH-+O2+2H2O═4Fe(OH)3↓ |
 [Cu(NH3)4]SO4•H2O是一种杀虫剂.
[Cu(NH3)4]SO4•H2O是一种杀虫剂.