题目内容
加碘盐有添加KIO3或KI两种,为探究某种加碘食盐,按以下步骤进行了实验:
①取适量加碘食盐置于烧杯中,加水溶解,制成溶液;
②取适量上述溶液于试管中,加入少许CCl4后滴加氯水,CCl4层变成紫色;继续滴加氯水,振荡,CCl4层紫色逐渐变浅,最后变成无色.
③另取适量所制食盐溶液于试管中,加入少许CCl4后滴加FeCl3溶液,CCl4层变成紫色.继续滴加FeCl3溶液,CCl4层的颜色没有变化.
请根据以上实验过程及现象,回答下列问题:
(1)用离子方程式和文字说明实验步骤②CCl4层变成紫色的原因:
(2)写出并配平CCl4层由紫色变成无色的化学反应方程式(计量数是1时不用填写):
→ + + HIO3+
(3)实验步骤②整个过程中做还原剂的物质是 .
(4)Cl2、HIO3、FeCl3氧化性由强到弱的顺序是 .
(5)要将加Kl的含碘量为20mg~50mg/kg的加碘盐1000kg,与Cl2反应转化成加KIO3的加碘盐,至少需要消耗Cl2 L(标准状况,保留2位小数).
①取适量加碘食盐置于烧杯中,加水溶解,制成溶液;
②取适量上述溶液于试管中,加入少许CCl4后滴加氯水,CCl4层变成紫色;继续滴加氯水,振荡,CCl4层紫色逐渐变浅,最后变成无色.
③另取适量所制食盐溶液于试管中,加入少许CCl4后滴加FeCl3溶液,CCl4层变成紫色.继续滴加FeCl3溶液,CCl4层的颜色没有变化.
请根据以上实验过程及现象,回答下列问题:
(1)用离子方程式和文字说明实验步骤②CCl4层变成紫色的原因:
(2)写出并配平CCl4层由紫色变成无色的化学反应方程式(计量数是1时不用填写):
→
(3)实验步骤②整个过程中做还原剂的物质是
(4)Cl2、HIO3、FeCl3氧化性由强到弱的顺序是
(5)要将加Kl的含碘量为20mg~50mg/kg的加碘盐1000kg,与Cl2反应转化成加KIO3的加碘盐,至少需要消耗Cl2
考点:探究物质的组成或测量物质的含量,氧化还原反应方程式的配平,氯、溴、碘及其化合物的综合应用
专题:氧化还原反应专题,卤族元素
分析:(1)根据氯气具有强氧化性,将碘离子氧化成碘单质,发生离子方程式为:2I-+Cl2═2Cl-+I2,碘单质易溶于CCl4,所以CCl4层变成紫色;
(2)根据碘单质溶于CCl4,所以CCl4层变成紫色,则继续滴加氯水,振荡,CCl4层紫色逐渐变浅,最后变成无色,说明碘单质又被氯气氧化成碘酸,根据得失电子守恒书写配平方程式;
(3)根据氯气氧化碘离子生成碘单质和氯气氧化碘单质生成碘酸结合化合价升高的做还原剂分析判断;
(4)根据步骤③另取适量所制食盐溶液于试管中,加入少许CCl4后滴加FeCl3溶液,CCl4层变成紫色,说明FeCl3将电离子氧化成碘单质,继续滴加FeCl3溶液,CCl4层的颜色没有变化,说明FeCl3不能继续氧化碘单质,据此分析;
(5)由信息写出反应方程式:KI+3Cl2+3H2O=KIO3+6HCl,根据化学方程式计算,按最小值计算.
(2)根据碘单质溶于CCl4,所以CCl4层变成紫色,则继续滴加氯水,振荡,CCl4层紫色逐渐变浅,最后变成无色,说明碘单质又被氯气氧化成碘酸,根据得失电子守恒书写配平方程式;
(3)根据氯气氧化碘离子生成碘单质和氯气氧化碘单质生成碘酸结合化合价升高的做还原剂分析判断;
(4)根据步骤③另取适量所制食盐溶液于试管中,加入少许CCl4后滴加FeCl3溶液,CCl4层变成紫色,说明FeCl3将电离子氧化成碘单质,继续滴加FeCl3溶液,CCl4层的颜色没有变化,说明FeCl3不能继续氧化碘单质,据此分析;
(5)由信息写出反应方程式:KI+3Cl2+3H2O=KIO3+6HCl,根据化学方程式计算,按最小值计算.
解答:
解:(1)因为氯气具有强氧化性,将碘离子氧化成碘单质,发生离子方程式为:2I-+Cl2═2Cl-+I2,碘单质易溶于CCl4,所以CCl4层变成紫色,故答案为:氯气将碘离子氧化成碘单质,碘单质易溶于CCl4,所以CCl4层变成紫色,离子方程式为:2I-+Cl2═2Cl-+I2;
(2)因为碘单质溶于CCl4,所以CCl4层变成紫色,则继续滴加氯水,振荡,CCl4层紫色逐渐变浅,最后变成无色,说明碘单质又被氯气氧化成碘酸,则根据得失电子守恒,方程式为:5Cl2+I2+6H2O=2HIO3+10HCl;故答案为:5Cl2+I2+6H2O=2HIO3+10HCl;
(3)由步骤②氯气先氧化碘离子生成碘单质,后继续通氯气,氯气氧化碘单质生成碘酸,所以根据化合价升高的做还原剂,则做还原剂的物质是碘离子、碘单质,故答案为:碘离子、碘单质;
(4)根据步骤③另取适量所制食盐溶液于试管中,加入少许CCl4后滴加FeCl3溶液,CCl4层变成紫色,说明FeCl3将电离子氧化成碘单质,继续滴加FeCl3溶液,CCl4层的颜色没有变化,说明FeCl3不能继续氧化碘单质,而根据步骤②氯气还可以继续氧化碘单质,所以Cl2、HIO3、FeCl3氧化性由强到弱的顺序是Cl2>HIO3>FeCl3;故答案为:Cl2>HIO3>FeCl3;
(5)1000kg加碘食盐中含碘20g,KI+3Cl2+3H2O=KIO3+6HCl,根据KIO3~I~KI~3Cl2可知,则需要消耗标准状况下Cl2的体积为:
×3×22.4L/mol=10.58L;答:10.58;
(2)因为碘单质溶于CCl4,所以CCl4层变成紫色,则继续滴加氯水,振荡,CCl4层紫色逐渐变浅,最后变成无色,说明碘单质又被氯气氧化成碘酸,则根据得失电子守恒,方程式为:5Cl2+I2+6H2O=2HIO3+10HCl;故答案为:5Cl2+I2+6H2O=2HIO3+10HCl;
(3)由步骤②氯气先氧化碘离子生成碘单质,后继续通氯气,氯气氧化碘单质生成碘酸,所以根据化合价升高的做还原剂,则做还原剂的物质是碘离子、碘单质,故答案为:碘离子、碘单质;
(4)根据步骤③另取适量所制食盐溶液于试管中,加入少许CCl4后滴加FeCl3溶液,CCl4层变成紫色,说明FeCl3将电离子氧化成碘单质,继续滴加FeCl3溶液,CCl4层的颜色没有变化,说明FeCl3不能继续氧化碘单质,而根据步骤②氯气还可以继续氧化碘单质,所以Cl2、HIO3、FeCl3氧化性由强到弱的顺序是Cl2>HIO3>FeCl3;故答案为:Cl2>HIO3>FeCl3;
(5)1000kg加碘食盐中含碘20g,KI+3Cl2+3H2O=KIO3+6HCl,根据KIO3~I~KI~3Cl2可知,则需要消耗标准状况下Cl2的体积为:
| 20g |
| 127g/mol |
点评:此题考查氧化还原反应的配平、氧化剂和还原剂、氧化性强弱的判断、化学计算知识,此题解答中用到了守恒法,牢牢抓住了守恒,简化了计算过程,顺利解答.

练习册系列答案
相关题目
下列反应的离子方程式书写正确的是( )
| A、钠和冷水反应:Na+2H2O═Na++2OH-+H2↑ |
| B、金属铝溶于氢氧化钠溶液:Al+2OH-═AlO2-+H2↑ |
| C、向Al2(SO4)3溶液中加入过量的氨水:Al3++3NH3?H2O=Al(OH)3↓+3NH4+ |
| D、少量SO2通入漂白粉溶液中:SO2+H2O+Ca2++2ClO-═CaSO3↓+2HClO |
常温下,用0.1000mol/L的HCl溶液滴定20.00mL 0.1000mol/L NH3?H2O溶液,滴定曲线如下图.下列说法不正确的是( )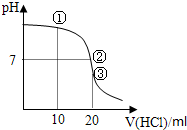

| A、①溶液:c(C1-)>c(NH4+)>c(OH-)>c(H+) |
| B、②溶液:c(NH4+)=c(C1-)>c(OH-)=c(H+) |
| C、③溶液:c(H+)>c(NH3?H2O)>c(OH-) |
| D、滴定过程中可能出现:c(NH3?H2O)>c(NH4+)>c(OH-)>c(Cl-)>c(H+) |

 )是食品添加剂的增香原料,其合成路线如下:
)是食品添加剂的增香原料,其合成路线如下:

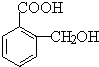 ,在一定条件下可以合成聚酯高分子,写出该聚酯高分子的结构简式
,在一定条件下可以合成聚酯高分子,写出该聚酯高分子的结构简式
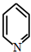 )且环上只有2个取代基;
)且环上只有2个取代基;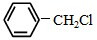 和
和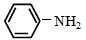 为原料合成西佛碱N-苯基苯甲亚胺(
为原料合成西佛碱N-苯基苯甲亚胺(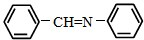 ),请你拟出合成路线:
),请你拟出合成路线:
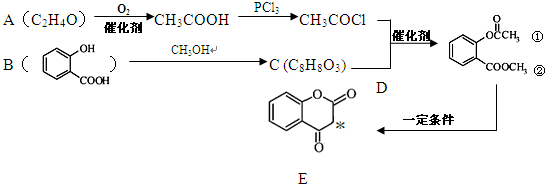
 )是一种重要的有机合成中间体.写出以苯酚、甲苯为基本原料制取该化合物的合成路线流程图.请注意:1.可选用必要的无机原料;2.已知酚羟基一般不易直接与羧酸发生类似酯化的反应,以上C→D的方法可供参照.
)是一种重要的有机合成中间体.写出以苯酚、甲苯为基本原料制取该化合物的合成路线流程图.请注意:1.可选用必要的无机原料;2.已知酚羟基一般不易直接与羧酸发生类似酯化的反应,以上C→D的方法可供参照.