题目内容
KMnO4与过量浓盐酸充分反应,化学方程式如下:2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O
请回答下列问题:
(1)该反应的氧化产物是 (请写出化学式).
(2)该反应中氧化剂与还原剂物质的量之比是 ;
(3)浓盐酸在反应中显示出来的性质是 (填编号)
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(4)如果该反应中有1mol电子转移,生成的气体在标准状况下的体积为 L.
请回答下列问题:
(1)该反应的氧化产物是
(2)该反应中氧化剂与还原剂物质的量之比是
(3)浓盐酸在反应中显示出来的性质是
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(4)如果该反应中有1mol电子转移,生成的气体在标准状况下的体积为
考点:氧化还原反应的计算
专题:氧化还原反应专题
分析:(1)得电子化合价降低的反应物是氧化剂、失电子化合价升高的反应物是还原剂,还原剂对应的产物是氧化产物、氧化剂对应的产物是还原产物,据此分析解答;
(2)化合价升高元素所在的反应物是还原剂,化合价降低元素所在的反应物是氧化剂;
(3)在氧化还原反应中,失电子化合价升高的元素被氧化;如果有盐酸的氢离子参加了反应而酸根离子未参加反应,那么盐酸就表现出酸性;该反应中部分盐酸中Cl元素化合价不变、部分Cl元素化合价由-1价变为0价,所以浓盐酸作酸、还原剂,体现酸性和还原性;
(4)每生成1mol氯气转移的电子数为2mol,所以转移1mol电子会产生0.5mol氯气;
(2)化合价升高元素所在的反应物是还原剂,化合价降低元素所在的反应物是氧化剂;
(3)在氧化还原反应中,失电子化合价升高的元素被氧化;如果有盐酸的氢离子参加了反应而酸根离子未参加反应,那么盐酸就表现出酸性;该反应中部分盐酸中Cl元素化合价不变、部分Cl元素化合价由-1价变为0价,所以浓盐酸作酸、还原剂,体现酸性和还原性;
(4)每生成1mol氯气转移的电子数为2mol,所以转移1mol电子会产生0.5mol氯气;
解答:
解:(1)由方程式可知,反应中Cl元素化合价由-1价升高到0价,被氧化,HCl为还原剂,氧化产物是Cl2,
故答案为:Cl2;
(2)由方程式可知,反应中Mn元素化合价由+7价降低到+2价,被氧化,KMnO4为氧化剂,Cl元素化合价由-1价升高到0价,被氧化,HCl为还原剂,16HCl,其中2KCl、2MnCl2、Cl元素化合价不变,变化的为10Cl,所以该反应中氧化剂与还原剂物质的量之比是2:10=1:5,
故答案为:1:5;
(3)反应中氯元素的化合价升高,则氯元素失去电子,该反应中部分盐酸中Cl元素化合价不变、部分Cl元素化合价由-1价变为0价,所以浓盐酸作酸、还原剂,体现酸性和还原性;
故答案为:②;
(4)Mn元素化合价由+7价降低到+2价,Cl元素化合价由-1价升高到0价,
2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O 转移电子数
5×22.4L 10mol
0.5×22.4L 1mol
故答案为:11.2L;
故答案为:Cl2;
(2)由方程式可知,反应中Mn元素化合价由+7价降低到+2价,被氧化,KMnO4为氧化剂,Cl元素化合价由-1价升高到0价,被氧化,HCl为还原剂,16HCl,其中2KCl、2MnCl2、Cl元素化合价不变,变化的为10Cl,所以该反应中氧化剂与还原剂物质的量之比是2:10=1:5,
故答案为:1:5;
(3)反应中氯元素的化合价升高,则氯元素失去电子,该反应中部分盐酸中Cl元素化合价不变、部分Cl元素化合价由-1价变为0价,所以浓盐酸作酸、还原剂,体现酸性和还原性;
故答案为:②;
(4)Mn元素化合价由+7价降低到+2价,Cl元素化合价由-1价升高到0价,
2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O 转移电子数
5×22.4L 10mol
0.5×22.4L 1mol
故答案为:11.2L;
点评:本题考查氧化还原反应,侧重于学生的分析能力和计算能力的考查,为高频考点,注意从元素化合价的角度认识氧化还原反应的相关概念和物质的性质,题目难度不大.

练习册系列答案
相关题目
2008年3月22日是第16个世界水日 (World Water Day),由于2008年是国际环境卫生年,因此2008年世界水日的主题为“涉水卫生”.水对人类的生存具有非常重要的意义,没有水就不可能有生机勃勃的地球,所以保护水资源是人类共同的责任.下列各项能造成水质严重污染的是
①生活污水的任意排放 ②海上油轮的原油泄漏 ③水力发电 ④农药化肥的不合理使用 ⑤使用无磷洗衣粉( )
①生活污水的任意排放 ②海上油轮的原油泄漏 ③水力发电 ④农药化肥的不合理使用 ⑤使用无磷洗衣粉( )
| A、只有①②③ | B、只有①②④ |
| C、只有③⑤ | D、只有②③⑤ |
 在某恒容密闭容器中通入一定量的二氧化氮,发生反应:2NO2(g)?N2O4(g),测定体系中x随着反应温度(T)变化的关系如图所示,下列关于x说法正确的是( )
在某恒容密闭容器中通入一定量的二氧化氮,发生反应:2NO2(g)?N2O4(g),测定体系中x随着反应温度(T)变化的关系如图所示,下列关于x说法正确的是( )| A、表示二氧化氮的转化率 |
| B、表示二氧化氮的体积分数 |
| C、表示该反应的平衡常数 |
| D、表示该密闭容器混合气体的密度 |
常温下,用0.1000mol/L的HCl溶液滴定20.00mL 0.1000mol/L NH3?H2O溶液,滴定曲线如下图.下列说法不正确的是( )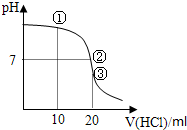

| A、①溶液:c(C1-)>c(NH4+)>c(OH-)>c(H+) |
| B、②溶液:c(NH4+)=c(C1-)>c(OH-)=c(H+) |
| C、③溶液:c(H+)>c(NH3?H2O)>c(OH-) |
| D、滴定过程中可能出现:c(NH3?H2O)>c(NH4+)>c(OH-)>c(Cl-)>c(H+) |
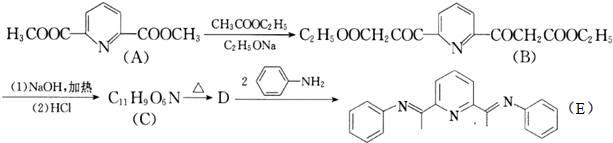
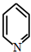 )且环上只有2个取代基;
)且环上只有2个取代基;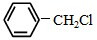 和
和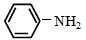 为原料合成西佛碱N-苯基苯甲亚胺(
为原料合成西佛碱N-苯基苯甲亚胺(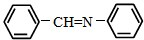 ),请你拟出合成路线:
),请你拟出合成路线:

 )的衍生物;
)的衍生物; 为原料制备化合物B的合成路线流程图(无机试剂任选).合成路线流程图示例如下:H2C═CH2
为原料制备化合物B的合成路线流程图(无机试剂任选).合成路线流程图示例如下:H2C═CH2
