题目内容
10.对于中学化学常见物质:钠、铁、氧化钠、过氧化钠、二氧化硫、二氧化氮.根据它们在一定条件下能否与H2O发生氧化还原反应进行的分类如下:
请回答下列问题:
①淡黄色固体属于丁(从“甲~丁”选填)组,乙组中物质包括
 (填写电子式).
(填写电子式).②甲组中的物质能使溴水褪色,其反应的离子方程式为SO2+Br2+2H2O═4H++SO42-+2Br-.
③丙组中的某一物质须在高温时才能与水蒸气反应,其化学方程式为3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2.另一物质投入足量的Ca(HCO3)2溶液中反应产生气体和沉淀,写出生成沉淀的离子方程式为OH-+HCO3-+Ca2+═H2O+CaCO3↓.
分析 根据它们在一定条件下能否与水发生氧化还原反应进行分类,钠(Na)、铁(Fe)、氧化钠(Na2O)、过氧化钠(Na2O2)、二氧化硫(SO2)、二氧化氮(NO2)等中学化学常见物质;依据分组后的性质分析判断,甲组、与水反应生成的溶液呈酸性,二氧化硫(SO2)、二氧化氮(NO2);乙组生成物水溶液呈碱性为钠(Na)、氧化钠(Na2O)、过氧化钠(Na2O2);丙组水是氧化剂为:钠(Na)、铁(Fe);丁组与水反应水即不是氧化剂也不是还原剂的是:过氧化钠(Na2O2)、二氧化氮(NO2),以此解答该题.
解答 解:①淡黄色固体是过氧化钠,属于丁组物质,B组中物质生成物水溶液呈碱性为Na2O,电子式为: ,故答案为:丁;
,故答案为:丁; ;
;
②甲组中的物质能使溴水褪色,应为还原性的二氧化硫,其反应的离子方程式为SO2+Br2+2H2O=4H++SO42-+2Br-;
故答案为:SO2+Br2+2H2O═4H++SO42-+2Br-;
③丙组中的某一物质须在加热时才能与水蒸气反应为Fe,铁和水蒸气反应生成四氧化三铁和氢气,反应的化学方程式为:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2;另一物质投入足量的Ca(HCO3)2溶液中,发生反应的离子方程式为2Na+2H2O=2Na++2OH-+H2↑,OH-+HCO3-+Ca2+=H2O+CaCO3↓;
故答案为:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2;OH-+HCO3-+Ca2+═H2O+CaCO3↓.
点评 本题易氧化还原反应为载体考查了元素化合物知识,为高频考点,侧重考查学生的分析能力和元素化合物知识的综合理解和运用,根据物质的性质分析解答即可,注意过氧化钠中O元素化合价,注意铁和水蒸气反应生成物,这些都是易错点,题目难度中等.

 科学实验活动册系列答案
科学实验活动册系列答案| A. | 原子半径:Y>X | B. | 原子序数:Y>X | ||
| C. | 电子层数:Y>X | D. | 最外层电子数:Y>X |
| A. | 该反应常温下能自发进行,高温和催化剂只是加快反应的速率 | |
| B. | 该反应中反应物的总能量低于生成物的总能量 | |
| C. | 反应达到平衡后,NO的反应速率保持恒定 | |
| D. | 单位时间内消耗CO和CO2的物质的量相等时,反应达到平衡 |
| A. | 5ml | B. | 15ml | C. | 20ml | D. | 25ml |
| A. | 金属铜制成纳米铜 | B. | 把水变成汽油 | ||
| C. | 热核聚变把氢原子变成氦原子 | D. | 干冰变成原子晶体 |
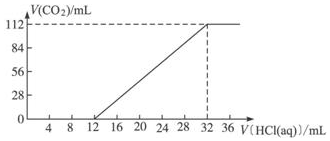 ⅠA族金属元素(R)组成的两种碳酸盐R2CO3与RHCO3的混合物6.14g,加水溶解后,取所得溶液的十分之一,向其中缓缓加入一定浓度的稀盐酸,并同时记录放出CO2的体积(已折算成标准状况下的体积)和消耗稀盐酸的体积,得到如图所示的曲线.
ⅠA族金属元素(R)组成的两种碳酸盐R2CO3与RHCO3的混合物6.14g,加水溶解后,取所得溶液的十分之一,向其中缓缓加入一定浓度的稀盐酸,并同时记录放出CO2的体积(已折算成标准状况下的体积)和消耗稀盐酸的体积,得到如图所示的曲线.
 .
.