题目内容
11.在加热的条件下,应用下述反应可制备氯气:MnO2+4HCl(浓)═MnCl2+Cl2↑+2H2O.已知17.4g二氧化锰完全反应后,最终溶液体积仍为0.5L.试求:(1)忽略氯气的溶解,标况下可收集多少体积的气体?(2)忽略反应前后溶液体积的变化,提供的浓盐酸为12mol•L-1,则反应结束后C(Cl-)为多少?(要求:要有一定的计算过程.)分析 (1)n(MnO2)=$\frac{17.4g}{87g/mol}$=0.2mol,结合反应的方程式可计算生成氢气的体积;
(2)根据反应生成的氯气的物质的量可以求出溶液中减少的氯离子的物质的量,然后求出剩余的氯离子的物质的量和浓度.
解答 解:(1)n(MnO2)=$\frac{17.4g}{87g/mol}$=0.2mol,
MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2 +Cl2 ↑+2H2O
1mol 22.4L
0.2mol V
V=$\frac{0.2mol×22.4L}{1mol}$=4.48L,
答:产生的氯气在标况下的体积为4.48L;
(2)反应生成的氯气的物质的量为$\frac{4.48L}{22.4L/mol}$=0.2mol,则溶液中减少的氯离子为0.4mol,则反应结束后c(Cl-)=$\frac{12mol/L×0.5L-0.4mol}{0.5L}$=11.2mol/L;
答:反应结束后C(Cl-)为11.2mol/L.
点评 本题考查化学方程式的计算,题目难度中等,注意物质的量应用于化学方程式的计算方法的运用,注意相关物理量的计算公式的运用.

练习册系列答案
 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案
相关题目
1.甲苯苯环上的三溴代物有( )
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
2.下列离子方程式中,正确的是( )
| A. | Na2O2与H2O反应:Na2O2+H2O═2Na++2OH-+O2↑ | |
| B. | AlCl3溶液中滴加过量的氨水:Al3++4 NH3•H2O═AlO2-+2H2O+4NH4+ | |
| C. | 铜与浓硝酸反应:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O | |
| D. | 向小苏打溶液中滴入醋酸:CO32-+2CH3COOH═CO2↑+H2O+2CH3COO- |
19.下列关于物质的检验或除杂的说法中正确的是( )
| A. | 除去CO2中混有的少量HCl气体,可将其通过饱和Na2CO3溶液 | |
| B. | 铁粉中混有少量铝粉,可加入NaOH溶液,充分反应后过滤除去 | |
| C. | 将某化合物进行焰色实验,观察焰色为黄色,说明不含K+ | |
| D. | 向某溶液中加入BaCl2溶液,产生大量白色沉淀,说明溶液中含有SO42- |
6.将50mL2mol•L-1的NaCl溶液加水稀释成1mol•L-1的NaCl溶液时,稀释后溶液的体积为( )
| A. | 100mL | B. | 200mL | C. | 150mL | D. | 50mL |
3.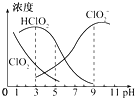 亚氯酸钠在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用 但ClO2是有毒的气体,25℃时各离子浓度随pH变化如图所示下列分析错误的是( )
亚氯酸钠在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用 但ClO2是有毒的气体,25℃时各离子浓度随pH变化如图所示下列分析错误的是( )
 亚氯酸钠在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用 但ClO2是有毒的气体,25℃时各离子浓度随pH变化如图所示下列分析错误的是( )
亚氯酸钠在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用 但ClO2是有毒的气体,25℃时各离子浓度随pH变化如图所示下列分析错误的是( )| A. | 25℃时HClO2的电离平衡常数Ka=10-6 | |
| B. | 使用漂白剂的最佳pH为3 | |
| C. | 25℃时,等浓度的HClO2溶液和NaClO2溶液等体积混合混合溶液中c(HClO2)+2c(H+)=c(ClO2-)+2c(OH-) | |
| D. | 25℃时 用0.1000mol/LNaOH溶液滴定20.00ml某未知浓度的HClO2溶液 当滴入NaOH溶液体积为20.00ml时溶液呈中性 则HClO2溶液的实际浓度为0.11mol/L |
20.下列水解离子方程式表达正确的是( )
| A. | CH3COONa的溶液:CH3COO-+H2O═CH3COOH+OH- | |
| B. | NH4Cl的溶液:NH4++H2O?NH3•H2O+H+ | |
| C. | Na2CO3的溶液:CO32-+H2O?H2CO3+2OH- | |
| D. | AlCl3的溶液:Al3++3H2O═Al(OH)3↓+3H+ |
1.以下条件最有利于反应的自发进行的是( )
| A. | △S>0,△H>0 | B. | △S<0,△H<0 | C. | △S<0,△H>0 | D. | △S>0,△H<0 |