题目内容
16.写出下列反应的离子方程式(1)用石灰石与盐酸反应制取二氧化碳CaCO3+2H+=Ca2++CO2↑+H2O;
(2)锌粉加入硫酸溶液中Zn+2H+=Zn2++H2↑.
分析 (1)碳酸钙与盐酸反应生成氯化钙和二氧化碳和水;
(2)锌与稀硫酸反应生成硫酸锌和氢气.
解答 解:(1)碳酸钙与盐酸反应生成氯化钙和二氧化碳和水,离子方程式为:CaCO3+2H+=Ca2++CO2↑+H2O;
故答案为:CaCO3+2H+=Ca2++CO2↑+H2O;
(2)锌为活泼金属,锌与稀硫酸反应生成硫酸锌和氢气,反应的离子方程式为:Zn+2H+=Zn2++H2↑,
故答案为:Zn+2H+=Zn2++H2↑.
点评 本题考查了离子方程式的书写,明确反应实质是解题关键,注意化学式的拆分,注意微溶物在书写离子方程式时,作为反应物如果为澄清溶液应拆成离子形式,如果为乳浊液应保留化学式,作为生成物必须保留化学式,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
6.下列物质中属于强电解质且能导电的是( )
| A. | NaOH溶液 | B. | Cu | C. | 冰醋酸 | D. | 熔化的KOH |
4.下列各组物质的溶液,不用其他试剂就能一一鉴别出来的是( )
| A. | K2SO4、HNO3、BaCl2 | B. | NaOH、NaCl、CuCl2 | ||
| C. | BaCl2、Na2CO3、HCl | D. | KCl、H2SO4、AgNO3 |
1.下列说法正确的是( )
| A. | 按系统命名法,CH3CH(C2H5)CH(C2H5)CH3的名称是2,3-二乙基丁烷 | |
| B. | 等质量的甲醛与乳酸[CH3CH(OH)COOH]完全燃烧消耗氧气的量不相等 | |
| C. | 通过石油裂解可以得到乙烯、丙烯、甲烷、苯、甲苯等重要化工基本原料 | |
| D. | 用Na2CO3溶液能区分CH3COOH、CH3CH2OH、苯、硝基苯四种物质 |
8.氮的固定是几百年来科学家一直研究的课题.
(1)如表列举了不同温度下大气固氮和工业固氮的部分K值.
①分析数据可知:大气固氮反应属于吸热(填“吸热”或“放热”)反应.
②分析数据可知:人类不适合大规模模拟大气固氮的原因K值小,正向进行的程度小(或转化率低),不适合大规模生产.
③从平衡视角考虑,工业固氮应该选择常温条件,但实际工业生产却选择500℃左右的高温,解释其原因从反应速率角度考虑,高温更好,但从催化剂活性等综合因素考虑选择500℃左右合适.
(2)工业固氮反应中,在其他条件相同时,分别测定N2的平衡转化率在不同压强(р1、р2)下随温度变化的曲线,如图所示的图示中,正确的是A(填“A”或“B”);比较р1、р2的大小关系р2>р1.
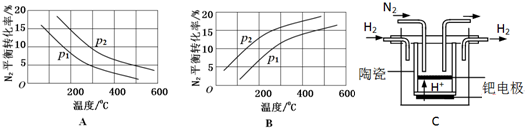
(3)20世纪末,科学家采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现高温常压下的电化学合成氨,提高了反应物的转化率,其实验简图如C所示,阴极的电极反应式是N2+6e-+6H+=2NH3.
(4)近年,又有科学家提出在常温、常压、催化剂等条件下合成氨气的新思路,反应原理为:2N2(g)+6H2O(1)?4NH3(g)+3O2(g),则其反应热△H=+1530kJ•mol-1.
(已知:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1,2H2(g)+O2(g)?2H2O(l)△H=-571.6kJ•mol-1)
(1)如表列举了不同温度下大气固氮和工业固氮的部分K值.
| 反应 | 大气固氮 N2(g)+O2(g)?2NO(g) | 工业固氮 N2(g)+3H2(g)?2NH3(g) | |||
| 温度/℃ | 27 | 2000 | 25 | 400 | 450 |
| K | 3.84×10-31 | 0.1 | 5×108 | 0.507 | 0.152 |
②分析数据可知:人类不适合大规模模拟大气固氮的原因K值小,正向进行的程度小(或转化率低),不适合大规模生产.
③从平衡视角考虑,工业固氮应该选择常温条件,但实际工业生产却选择500℃左右的高温,解释其原因从反应速率角度考虑,高温更好,但从催化剂活性等综合因素考虑选择500℃左右合适.
(2)工业固氮反应中,在其他条件相同时,分别测定N2的平衡转化率在不同压强(р1、р2)下随温度变化的曲线,如图所示的图示中,正确的是A(填“A”或“B”);比较р1、р2的大小关系р2>р1.

(3)20世纪末,科学家采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现高温常压下的电化学合成氨,提高了反应物的转化率,其实验简图如C所示,阴极的电极反应式是N2+6e-+6H+=2NH3.
(4)近年,又有科学家提出在常温、常压、催化剂等条件下合成氨气的新思路,反应原理为:2N2(g)+6H2O(1)?4NH3(g)+3O2(g),则其反应热△H=+1530kJ•mol-1.
(已知:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1,2H2(g)+O2(g)?2H2O(l)△H=-571.6kJ•mol-1)
5.下列说法正确的是( )
| A. | 二氧化硅溶于水显酸性 | |
| B. | 二氧化碳通入水玻璃(Na2SiO3的水溶液)可以得到白色胶状物质 | |
| C. | 因为高温时,二氧化硅与碳酸钠反应放出二氧化碳,所以硅酸的酸性比碳酸强 | |
| D. | 二氧化硅是酸性氧化物,它不溶于任何酸 |
6.25℃时,某溶液的c(OH-)=10-5mol•L-1,其PH值为( )
| A. | 5 | B. | 9 | C. | 7 | D. | 14 |
 用脱脂棉包住0.2g过氧化钠粉末,置于石棉网上,往脱脂棉上滴几滴水,可观察到脱脂棉剧烈燃烧起来.
用脱脂棉包住0.2g过氧化钠粉末,置于石棉网上,往脱脂棉上滴几滴水,可观察到脱脂棉剧烈燃烧起来.