题目内容
下列关于16O和18O说法正确的是( )
| A、16O2与18O2互为同素异形体 |
| B、16O与18O核外电子排布方式不同 |
| C、通过化学变化可以实现16O与18O间的相互转化 |
| D、16O与18O是氧元素的两种核素 |
考点:核素
专题:原子组成与结构专题
分析:A.由同种元素形成的不同种单质互为同素异形体;
B.核外电子排布方式取决于核素核外电子数和质子数;
C.核反应既不是物理变化又不是化学变化;
D.16O和18O是互为同位素的两个原子,它们都是氧元素的核素.
B.核外电子排布方式取决于核素核外电子数和质子数;
C.核反应既不是物理变化又不是化学变化;
D.16O和18O是互为同位素的两个原子,它们都是氧元素的核素.
解答:
解:A.18O2与16O2的是由氧的不同核素组成的同种物质,故A错误;
B.核外电子排布方式取决于核素核外电子数和质子数,二者相同则核外电子排布方式相同,故B错误;
C.16O与18O之间的转化,属于原子核的变化,不是化学变化,故C错误;
D.16O和18O它们都是氧元素的核素,故D正确.
故选D.
B.核外电子排布方式取决于核素核外电子数和质子数,二者相同则核外电子排布方式相同,故B错误;
C.16O与18O之间的转化,属于原子核的变化,不是化学变化,故C错误;
D.16O和18O它们都是氧元素的核素,故D正确.
故选D.
点评:本题主要考查的是核素的概念,同素异形体的概念等,难度不大,明确氧元素的两种核素间的关系(质子数相同,中子数不同)是解题关键.

练习册系列答案
相关题目
下列反应的离子方程式正确的是( )
| A、在硫化钠溶液中加入足量稀硝酸:S2-+2H+=H2S↑ | ||||
| B、往氯化铁溶液中通入硫化氢气体:2Fe3++S2-=2Fe2++S↓ | ||||
C、用惰性电极电解饱和食盐水:2Cl-+2H2O
| ||||
D、乙醛的银镜反应:CH3CHO+2Ag(NH3)2OH
|
HClO中Cl元素的化合价为( )
| A、-1 | B、+1 | C、0 | D、+5 |
已知在一定条件下能发生下列反应:N2+3Mg
Mg3N2(固),空气缓缓通过下图装置时,依次除去的气体是( )

| ||

| A、CO2、H2O、O2、N2 |
| B、N2、O2、CO2、H2O |
| C、H2O、CO2、N2、O2 |
| D、CO2、N2、H2O、O2 |

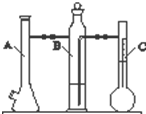 利用如图所示实验装置可以测定一定条件下1mol气体的体积.图中仪器C称为液体量瓶,瓶颈上有110~130mL刻度线.将一定质量的镁带和过量的稀硫酸在仪器A瓶中完全反应,产生的H2将B瓶中的液体压入液体量瓶中,根据液体的体积可以转换成H2的体积.
利用如图所示实验装置可以测定一定条件下1mol气体的体积.图中仪器C称为液体量瓶,瓶颈上有110~130mL刻度线.将一定质量的镁带和过量的稀硫酸在仪器A瓶中完全反应,产生的H2将B瓶中的液体压入液体量瓶中,根据液体的体积可以转换成H2的体积.