题目内容
某化学研究小组测定某FeCl3样品(含少量FeCl2杂质)中铁元素的质量分数,在实验室中按以下步骤进行实验:
①称取a g样品,置于烧杯中;
②取适量盐酸和适量蒸馏水使样品溶解,准确配制成250mL溶液;
③准确量取25.00mL步骤②中配得的溶液,置于烧杯中,加入适量的氯水,使反应完全;
④加入过量氨水,充分搅拌,使沉淀完全;
⑤过滤,洗涤沉淀;
⑥将沉淀转移到坩埚内,加热、搅拌,直到固体由红褐色全部变为红棕色,冷却至室温后,称量;
⑦…
请根据上面的叙述回答下列问题:
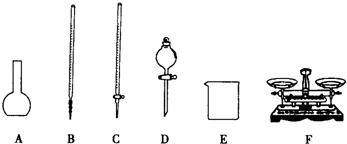
(1)如图所给仪器中,实验步骤①②③中必须用到的仪器是E和 (填仪器序号).还缺少的主要仪器名称是
(2)步骤④中所发生反应的离子方程式为
(3)步骤⑤中洗涤沉淀的操作是: ,检验沉淀是否洗净,应向洗涤液中加入几滴 (填写序号).
①KSCN溶液 ②NaOH溶液 ③AgNO3溶液 ④酚酞试液
(4)第⑥步的操作中,将沉淀物加热,冷却至室温,称量其质量为m1g,再次加热并冷却至室温称量其质量为m2g,实验至少需重复加热一次的原因是 ;若m1与m2差值较大,其原因可能是①第一次加热 ,②第二次加热 .(各答一种情况即可).
(5)若坩埚质量是W1g,最终坩埚和固体的总质量是W2g,则样品中铁元素的质量分数为 .
①称取a g样品,置于烧杯中;
②取适量盐酸和适量蒸馏水使样品溶解,准确配制成250mL溶液;
③准确量取25.00mL步骤②中配得的溶液,置于烧杯中,加入适量的氯水,使反应完全;
④加入过量氨水,充分搅拌,使沉淀完全;
⑤过滤,洗涤沉淀;
⑥将沉淀转移到坩埚内,加热、搅拌,直到固体由红褐色全部变为红棕色,冷却至室温后,称量;
⑦…
请根据上面的叙述回答下列问题:
(1)如图所给仪器中,实验步骤①②③中必须用到的仪器是E和

(2)步骤④中所发生反应的离子方程式为
(3)步骤⑤中洗涤沉淀的操作是:
①KSCN溶液 ②NaOH溶液 ③AgNO3溶液 ④酚酞试液
(4)第⑥步的操作中,将沉淀物加热,冷却至室温,称量其质量为m1g,再次加热并冷却至室温称量其质量为m2g,实验至少需重复加热一次的原因是
(5)若坩埚质量是W1g,最终坩埚和固体的总质量是W2g,则样品中铁元素的质量分数为
考点:探究物质的组成或测量物质的含量
专题:实验探究和数据处理题
分析:(1)根据各仪器的作用选取仪器;
(2)步骤④中所发生反应是铁离子和一水合氨反应生成氢氧化铁沉淀 的反应;
(3)依据沉淀洗涤的实验方法回答,在过滤装置中加入洗涤的蒸馏水浸没沉淀,使其自然流下,洗涤沉淀;沉淀吸附的是氯离子,用硝酸银溶液可以检验氯离子;
(4)重复加热使验证氢氧化铁是否完全分解;若m1与m2 差值较大,其原因可能是第一次加热不充分、加热过程中有固体溅出等;
(5)根据原子守恒计算铁元素的质量,再根据质量分数公式进行计算.
(2)步骤④中所发生反应是铁离子和一水合氨反应生成氢氧化铁沉淀 的反应;
(3)依据沉淀洗涤的实验方法回答,在过滤装置中加入洗涤的蒸馏水浸没沉淀,使其自然流下,洗涤沉淀;沉淀吸附的是氯离子,用硝酸银溶液可以检验氯离子;
(4)重复加热使验证氢氧化铁是否完全分解;若m1与m2 差值较大,其原因可能是第一次加热不充分、加热过程中有固体溅出等;
(5)根据原子守恒计算铁元素的质量,再根据质量分数公式进行计算.
解答:
解:(1)称量药品用天平,氯化铁和氯化亚铁的水溶液都呈酸性,所以准确量取25.00mL步骤②中配得的溶液用酸式滴定管,故仪器选C F;
配制一定物质的量浓度的溶液用容量瓶,还缺少的主要仪器名称是配置250ml溶液所需的250mL容量瓶;
故答案为:CF;250mL容量瓶;
(2)步骤④中所发生反应是铁离子和一水合氨反应生成氢氧化铁沉淀 的反应,反应的离子方程式为:Fe3++3NH3?H2O=Fe(OH)3+3NH4+;
故答案为:Fe3++3NH3?H2O=Fe(OH)3+3NH4+;
(3)步骤⑤中洗涤沉淀的操作为:沿玻璃棒向过滤器(或漏斗)中的沉淀上加蒸馏水至淹没沉淀,静置使其全部滤出,重复操作2-3次;沉淀吸附氯离子,常用硝酸银溶液检验氯离子,如果产生不溶于稀硝酸的白色沉淀,就证明含有氯离子,故选③;
故答案为:沿玻璃棒向过滤器(或漏斗)中的沉淀上加蒸馏水至淹没沉淀,静置使其全部滤出,重复操作2-3次;③;
(4)实验至少需重复加热一次的原因是验证氢氧化铁是否全部分解,若m1与m2 差值较大,其原因可能是:①第一次加热不够充分导致第二次加热时质量减少较多,②第一次冷却时没有将固体放置于干燥器中冷却,导致第一次减少质量较少,③加热过程中固体溅出或少量固体粘在玻璃棒上导致两者差较大;
故答案为:证明氢氧化铁受热分解完全;不够充分或冷却时没有将固体放置于干燥器中冷却;过程中有固体溅出或温度过高,固体有分解;
(5)若坩埚质量是W1 g,最终坩埚和固体的总质量是W2 g,则氧化铁的质量=(W2-W1)g,
铁元素的质量分数=
×100%=
%,
故答案为:
%.
配制一定物质的量浓度的溶液用容量瓶,还缺少的主要仪器名称是配置250ml溶液所需的250mL容量瓶;
故答案为:CF;250mL容量瓶;
(2)步骤④中所发生反应是铁离子和一水合氨反应生成氢氧化铁沉淀 的反应,反应的离子方程式为:Fe3++3NH3?H2O=Fe(OH)3+3NH4+;
故答案为:Fe3++3NH3?H2O=Fe(OH)3+3NH4+;
(3)步骤⑤中洗涤沉淀的操作为:沿玻璃棒向过滤器(或漏斗)中的沉淀上加蒸馏水至淹没沉淀,静置使其全部滤出,重复操作2-3次;沉淀吸附氯离子,常用硝酸银溶液检验氯离子,如果产生不溶于稀硝酸的白色沉淀,就证明含有氯离子,故选③;
故答案为:沿玻璃棒向过滤器(或漏斗)中的沉淀上加蒸馏水至淹没沉淀,静置使其全部滤出,重复操作2-3次;③;
(4)实验至少需重复加热一次的原因是验证氢氧化铁是否全部分解,若m1与m2 差值较大,其原因可能是:①第一次加热不够充分导致第二次加热时质量减少较多,②第一次冷却时没有将固体放置于干燥器中冷却,导致第一次减少质量较少,③加热过程中固体溅出或少量固体粘在玻璃棒上导致两者差较大;
故答案为:证明氢氧化铁受热分解完全;不够充分或冷却时没有将固体放置于干燥器中冷却;过程中有固体溅出或温度过高,固体有分解;
(5)若坩埚质量是W1 g,最终坩埚和固体的总质量是W2 g,则氧化铁的质量=(W2-W1)g,
铁元素的质量分数=
| ||
| ag |
| 700(W2-W1) |
| a |
故答案为:
| 700(W2-W1) |
| a |
点评:本题考查了探究物质的组成或测量物质的含量,难点是误差分析,根据原子守恒计算铁的质量分数,难度较大.

练习册系列答案
相关题目
28%的KOH溶液中,平均多少个水分子溶有一个K+( )
| A、6个 | B、8个 |
| C、10个 | D、28个 |
下列叙述正确的是( )
| A、1molNaOH的摩尔质量为40g |
| B、1mol 物质含有的微粒数就是6.02×1023 |
| C、1molN2的体积为22.4L |
| D、0.5molCO2约含有3.01×1023个CO2分子 |
下面是一段关于酸碱中和滴定的实验叙述:“取25.00mL未知浓度的盐酸溶液,下列标明序号的操作中,有错误的是( )
①放入锥形瓶中,此瓶需事先用蒸馏水洗净,
②并经待测溶液润洗过,
③加入几滴酚酞试液作指示剂,
④取一支酸式滴定管,经蒸馏水洗净后,
⑤直接往其中注入标准NaOH溶液,进行滴定,
⑥一旦发现溶液由无色变成粉红色,即停止滴定,记下数据.”
①放入锥形瓶中,此瓶需事先用蒸馏水洗净,
②并经待测溶液润洗过,
③加入几滴酚酞试液作指示剂,
④取一支酸式滴定管,经蒸馏水洗净后,
⑤直接往其中注入标准NaOH溶液,进行滴定,
⑥一旦发现溶液由无色变成粉红色,即停止滴定,记下数据.”
| A、④⑤⑥ | B、②④⑤⑥ |
| C、②④⑤ | D、②③⑤⑥ |
下列关于16O和18O说法正确的是( )
| A、16O2与18O2互为同素异形体 |
| B、16O与18O核外电子排布方式不同 |
| C、通过化学变化可以实现16O与18O间的相互转化 |
| D、16O与18O是氧元素的两种核素 |
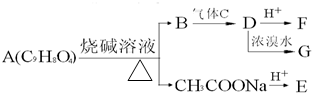 A为药用有机物,从A出发可发生如图所示的一系列反应.已知A在一定条件下能与醇发生酯化反应,A分子中的苯环上有两个取代基,且苯环上的一卤代物有两种,D不能与NaHCO3溶液反应,但能与NaOH溶液反应.请回答下列问题:
A为药用有机物,从A出发可发生如图所示的一系列反应.已知A在一定条件下能与醇发生酯化反应,A分子中的苯环上有两个取代基,且苯环上的一卤代物有两种,D不能与NaHCO3溶液反应,但能与NaOH溶液反应.请回答下列问题: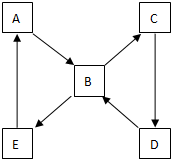 如图表示某固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去).单质A能与某气态单质化合生成化合物B.
如图表示某固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去).单质A能与某气态单质化合生成化合物B.