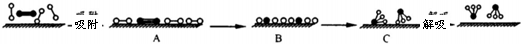题目内容
17.NA代表阿伏伽德罗常数,下列说法正确的是( )| A. | 100mL1mol/L的Na3PO4溶液中含有离子数多于0.4NA | |
| B. | 1molAlCl3跟水反应完全转化成氢氧化铝胶体后,生成胶体粒子的数目为1NA | |
| C. | 12g石墨晶体中含有碳碳键数目为2×6.02×1023 | |
| D. | 标准状况下,22.4LCHCl3中含有氯原子数目为3NA |
分析 A.磷酸根离子分步水解离子数增多;
B.氢氧化铝胶体粒子为氢氧化铝的聚集体;
C.石墨中每个C原子与其它3个C形成碳碳键,根据均摊法计算出12g石墨中含有的碳碳键;
D.标准状况,CHCl3不是气体.
解答 解:A.磷酸根离子分步水解离子数增多,100mL 1mol/L的Na3PO4溶液中含有离子数多于0.4NA,故A正确;
B.氢氧化铝胶体粒子为氢氧化铝的聚集体,无法计算氢氧化铝胶粒的数目,故B错误;
C.12g石墨中含有1molC,石墨中每个碳原子与其它3个C形成碳碳单键,每个C形成的碳碳键为:$\frac{1}{2}$×3=1.5,所以1molC形成了1.5mol碳碳键,12g石墨含有碳碳键数目为1.5NA,故C错误;
D.标准状况,CHCl3不是气体,22.4L CHCl3中物质的量不是1mol,故D错误.
故选A.
点评 本题考查阿伏加德罗常数的相关计算,题目难度不大,注意物质的组成、结构、性质以及物质存在的外界条件和聚集状态等问题.

练习册系列答案
相关题目
7.水银法电解食盐水是氯碱工业发展进程中的重要里程碑,以制得碱液纯度高、质量好而著称,其生产原理示意图如下.下列说法不正确的是( )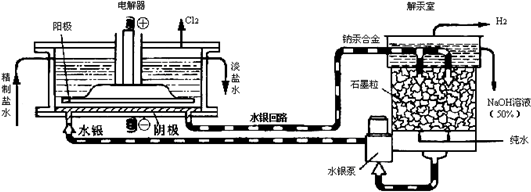

| A. | 电解器中阳极的电极反应式为:2Cl--2e-=Cl2↑ | |
| B. | 解汞室中产生氢气的电极为阴极 | |
| C. | 当阳极产生3.36 L(标准状况)气体时,解汞室中生成NaOH的质量为12 g | |
| D. | 在直流电作用下,电解器中的Na+变成金属钠,与水银形成钠汞合金,从而与Cl2分开 |
5.常温下,浓度均为0.1mol•L-1、体积均为100mL的两种一元酸HX、HY的溶液中,分别缴入NaOH固体,lg$\frac{c{(H}^{+})}{c{(OH}^{-})}$随加入NaOH的物质的量的变化如图所示.下列叙述正确的是( )
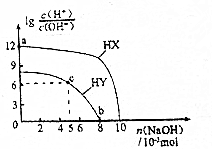

| A. | HX的酸性弱于HY | |
| B. | a点由水电离出的c(H+)=10-12mol•L-1 | |
| C. | c点溶液中:c(Y-)>c(HY) | |
| D. | b点时酸碱恰好完全中和 |
12.将38.4gCu与含有2mol HNO3的浓硝酸反应至铜完全溶解后,再向溶液中加人铜时,发现铜不再溶解.则在铜完全溶解时所放出的气体体积(标准状况下)为( )
| A. | 17.92L | B. | 22.4L | C. | 8.96L | D. | 11.2L |
2.在密闭容器中进行X2(g)+Y2(g)?2Z2(g),若X2、Y2的起始浓度分别为0.4mol/L、0.6mol/L,当反应达到平衡后各物质的浓度不可能是( )
| A. | X2为0.1mol/L | B. | X2为0.2mol/L | C. | Z2为0.3mol/L | D. | Z2为0.8mol/L |
19.粗铜中一般含有锌、铁、银、金等杂质.在下图所示的装置中,甲池的总反应方程式为2CH3OH+3O2+4KOH═2K2CO3+6H2O.接通电路一段时间后,纯铜电极质量增加了3.2g.在此过程中,下列说法正确的是( )

| A. | 乙池中CuSO4溶液的浓度不变 | |
| B. | 甲池中理论上消耗标准状况下空气的体积是2.8L(空气中O2体积分数以20%计算) | |
| C. | 甲池是电能转化为化学能的装置,乙池是化学能转化为电能的装置 | |
| D. | 甲池中通入CH3OH一极的电极反应为CH3OH-6e-+2H2O═CO32-+8H+ |
20.设NA表示阿伏加德罗常数的值,下列说法不正确的是( )
| A. | 1mol NH4+和1mol OH-所含电子数均为10NA | |
| B. | 14gC2H4和14gC3H6 所含原子数均为3NA | |
| C. | 1L l mol/LH2SO4溶液与足量Zn充分反应生成22.4L H2 | |
| D. | 标准状况下,11.2LSO3所含分子数为0.5NA |
 分别表示N2、H2、NH3和固体催化剂,则在固体催化剂表面合成氨的过程可用下图表示:
分别表示N2、H2、NH3和固体催化剂,则在固体催化剂表面合成氨的过程可用下图表示: