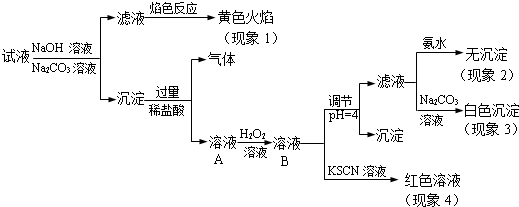
题目内容
8.1902年德国化学家哈伯研究出合成氨的方法,其反应原理为:N2(g)+3H2(g)?2NH3(g);△H(△H<0)(1)在一容积为4L的密闭容器中,加入0.4mol的N2和1.2mol的H2,在一定条件下发生反应,反应中NH3的物质的量浓度变化情况如图1:
①根据图1,计算从反应开始到平衡时,平均反应速率v(H2)为0.0375mol/(L•min).
②反应达到平衡后,第5分钟末,保持其它条件不变,若改变反应温度,则NH3的物质的量浓度不可能为AC.
A. 0.20mol/L B. 0.12mol/L C. 0.10mol/L D. 0.08mol/L
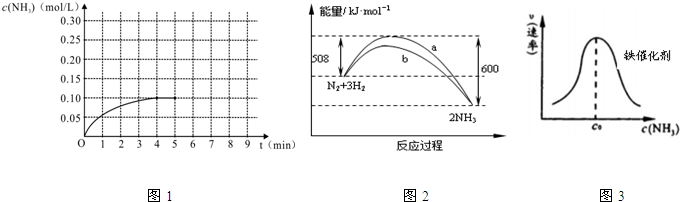
(2)某温度时,N2与H2反应过程中的能量变化如图2所示.下列叙述正确的是AB
A.b曲线是加入催化剂时的能量变化曲线
B.在密闭容器中加入1mol N2、3mol H2,充分反应放出的热量小于92kJ
C.由图可知,断开1mol 氮氮三键与1mol 氢氢键吸收的能量和小于形成1mol 氮氢键所放出的能量
D.反应物的总能量低于生成物的能量
(3)哈伯因证实N2、H2在固体催化剂(Fe)表面吸附和解吸以合成氨的过程而获诺贝尔奖.若用
 分别表示N2、H2、NH3和固体催化剂,则在固体催化剂表面合成氨的过程可用下图表示:
分别表示N2、H2、NH3和固体催化剂,则在固体催化剂表面合成氨的过程可用下图表示: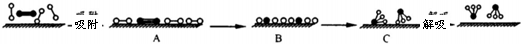
①吸附后,能量状态最低的是C(填字母序号).
②由上述原理,在铁表面进行NH3的分解实验,发现分解速率与浓度关系如图3.从吸附和解吸过程分析,c0前速率增加的原因可能是氨的浓度增加,催化剂表面吸附的氨分子增多,速率增大;c0后速率降低的原因可能是达到一定浓度后,氨分子浓度太大阻碍N2和H2的解吸.
(4)已知液氨中存在:2NH3(l)?NH2-+NH4+.用Pt电极对液氨进行电解也可产生H2和N2.阴极的电极反应式是2NH3+2e-=H2+2NH2-或2NH4++2e-=H2↑+2NH3.
分析 (1)①根据v(H2)=$\frac{3}{2}$c(NH3)进行计算;
②根据反应的可逆性特点以及温度改变平衡一定发生移动进行判断;
(2)A.加入催化剂能降低反应所需活化能;
B.在密闭容器中加入1mol N2、3mol H2,该反应是可逆反应,反应物不能完全转化;
C.由图可知,该反应是放热反应,即断键吸收的能量小于成键放出的能量;
D.反应物的总能量高于生成物的能量;
(3)①化学键的断裂要吸收能量,且该反应放热;
②c0前氨的浓度增加,导致反应速率加快;c0后由于氨分子浓度太大阻碍N2和H2的解吸;
(4)阴极上氨气或铵根离子得电子发生还原反应.
解答 解:(1)①根据图象分析平衡时氨气的浓度为0.1mol/L,时间为4min,所以依据速率之比等于系数之比得到:v(H2)=$\frac{3}{2}$v(NH3)=$\frac{3}{2}$×$\frac{0.1mol/L}{4min}$=0.0375 mol/(L•min),故答案为:0.0375;
②该反应为可逆反应,反应物不可能完全转化,则NH3的物质的量浓度不可能为0.2mol/L,温度改变平衡一定发生移动,则NH3的物质的量浓度不可能为0.1mol/L,故答案为:AC;
(2)A.加入催化剂能降低反应所需活化能,b所需活化能较小,所以b是加入催化剂的反应,故A正确;
B.在密闭容器中加入1mol N2、3mol H2,该反应是可逆反应,反应物不能完全转化,则充分反应放出的热量小于92kJ,故B正确;
C.由图可知,该反应是放热反应,断开1mol 氮氮三键与3mol 氢氢键吸收的能量和小于形成3mol 氮氢键所放出的能量,故C错误;
D.该反应是放热反应,反应物的总能量高于生成物的能量,故D错误;
故选AB;
(3)①由于化学键的断裂要吸收能量,故活化状态B的能量高于初始状态A的能量,而此反应为放热反应,故初始状态A的能量高于末态C的能量,故C的能量最低,故答案为:C;
②c0前氨的浓度增加,导致反应速率加快;c0后由于氨分子浓度太大阻碍N2和H2的解吸,故反应速率减慢,故答案为:氨的浓度增加,催化剂表面吸附的氨分子增多,速率增大;达到一定浓度后,氨分子浓度太大阻碍N2和H2的解吸;
(4)阴极上氨气或铵根离子得电子发生还原反应,电极反应式为2NH3+2e-=H2+2NH2- 或2NH4++2e-=H2↑+2NH3,
故答案为:2NH3+2e-=H2+2NH2- 或2NH4++2e-=H2↑+2NH3.
点评 本题考查化学平衡计算、化学平衡影响因素、电解原理等知识点,为高频考点,明确化学反应原理及电解原理是解本题关键,侧重考查学生分析计算能力,难点是电极反应式的书写,题目难度中等.

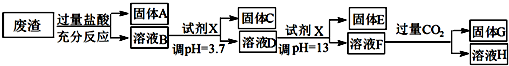
已知常温条件下:
①阳离子以氢氧化物形式完全沉淀(阳离子浓度低于10?5mol•L-1)时溶液的pH:
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| pH | 3.4 | 5.2 | 11 |
请回答:
(1)写出A与氢氟酸反应的化学方程式:SiO2+4HF=SiF4↑+2H2O.
(2)上述流程中两次使用试剂X,推测试剂X是氢氧化钠(填“氨水”或“氢氧化钠”)其理由是经过计算饱和氨水的pH=11,使用氨水不能将溶液调至pH=13,所以选择氢氧化钠调节溶液酸碱性.
(3)写出F→H的反应离子方程式:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(4)溶液D到固体E过程中需要控制溶液pH=13,如果pH过小,可能导致的后果是镁离子沉淀不完全或氢氧化铝溶解不完全.
(5)固体C跟HI反应的离子方程式为:2Fe(OH)3+2I-+6H+=2Fe2++I2+6H2O.
(6)试计算Mg(OH)2的Ksp=10-11.
| A. | 苹果放在空气中久置变黄和纸张久置变黄原理相似 | |
| B. | 用活性炭为蔗糖脱色和用臭氧漂白纸浆原理相似 | |
| C. | 钢铁制品和铜制品既能发生吸氧腐蚀又能发生析氢腐蚀 | |
| D. | 奥运会中采用的新型氢动力计程车可以降低PM2.5的排放,减小大气污染 |
| A. | 用稀HNO3溶解FeS固体:FeS+2H+═Fe2++H2S↑ | |
| B. | 氯气通入澄清石灰水中:Cl2+2OH-═Cl-+ClO-+H2O | |
| C. | SO2气体通入NaClO溶液中:SO2+2ClO-+H2O═SO${\;}_{3}^{2-}$+2HClO | |
| D. | 等体积、等物质的量浓度AlCl3与NaOH溶液混合:Al3++4OH-═AlO2-+H2O |
| A. | 某品牌化妆品声称“我们拒绝化学,本品不含任何化学物质” | |
| B. | 用漂粉精和洁厕灵的混合液清洗马桶效果更佳 | |
| C. | 最理想的“原子经济”就是反应物的原子全部转化为期望的最终产物 | |
| D. | 新核素的发现意味着新元素的合成 |
(1)早期冶炼金属锰的一种方法是先煅烧软锰矿生成Mn3O4,再利用铝热反应原理制得锰,该铝热反应的化学方程式为8Al+3Mn3O4$\frac{\underline{\;高温\;}}{\;}$4Al2O3+9Mn.
(2)现代冶炼金属锰的一种工艺流程如下图所示:

下表为t℃时,有关物质的pKsp(注:pKsp=-lgKsp).
| 物质 | Fe(OH)3 | Cu(OH)2 | Ca(OH)2 | Mn(OH)2 | CuS | CaS | MnS | MnCO3 |
| pKsp | 37.4 | 19.32 | 5.26 | 12.7 | 35.2 | 5.86 | 12.6 | 10.7 |
①该反应中,还原剂为C6H12O6.写出一种能提高还原浸出速率的措施:升高反应温度.
②滤液1的pH>(填“大于”、“小于”或“等于”)MnSO4浸出液的pH.
③加入MnF2的主要目的是除去Ca2+(填Ca2+、Fe3+或Cu2+).
(3)由MnSO4制取MnCO3:往MnSO4溶液中加入过量NH4HCO3溶液,该反应的离子方程式为Mn2++2HCO3-=MnCO3↓+H2O+CO2↑;若往MnSO4溶液中加入(NH4)2CO3溶液,还会产生Mn(OH)2,可能的原因是:MnCO3(s)+2OH-(aq)═Mn(OH)2(s)+CO32-(aq),t℃时,计算该反应的平衡常数K=100(填数值).
| A. | 100mL1mol/L的Na3PO4溶液中含有离子数多于0.4NA | |
| B. | 1molAlCl3跟水反应完全转化成氢氧化铝胶体后,生成胶体粒子的数目为1NA | |
| C. | 12g石墨晶体中含有碳碳键数目为2×6.02×1023 | |
| D. | 标准状况下,22.4LCHCl3中含有氯原子数目为3NA |