题目内容
11.下列说法不正确的是( )| A. | 天然植物油常温下一般呈液态,难溶于水,没有恒定的熔点、沸点 | |
| B. | 乙醛、乙酸和葡萄糖都能与新制的Cu(OH)2反应,且反应类型均为氧化反应 | |
| C. | 乙醛、氯乙烯和乙二醇均可作为合成聚合物的单体 | |
| D. | 石油催化裂化的主要目的是提高汽油等轻质油的产量与质量;石油裂解的主要目的是得到更多的乙烯、丙烯等气态短链烃 |
分析 A.天然植物油为混合物,成分为酯类物质;
B.乙酸与氢氧化铜发生中和反应,乙醛、葡萄糖含-CHO;
C.乙醛可以制取聚乙醛等、氯乙烯可以合成聚氯乙烯,乙二醇可以和乙二酸缩聚;
D.石油裂化提高汽油的含量,裂解得到小分子烯烃.
解答 解:A.天然植物油为混合物,成分为酯类物质,则常温下一般呈液态,难溶于水,没有恒定的熔点、沸点,故A正确;
B.乙酸与氢氧化铜发生中和反应,乙醛、葡萄糖含-CHO,与氢氧化铜发生氧化反应,故B错误;
C.乙醛可以制取聚乙醛等、氯乙烯可以合成聚氯乙烯,乙二醇可以和乙二酸缩聚,则乙醛、氯乙烯和乙二醇均可作为合成聚合物的单体,故C正确;
D.石油裂化提高汽油的含量,裂解得到小分子烯烃,即石油催化裂化的主要目的是提高汽油等轻质油的产量与质量;石油裂解的主要目的是得到更多的乙烯、丙烯等气态短链烃,故D正确;
故选B.
点评 本题考查有机物的结构与性质,为高频考点,把握有机物的组成、性质、有机反应为解答的关键,侧重分析与应用能力的考查,注意石油的综合利用,题目难度不大.

练习册系列答案
相关题目
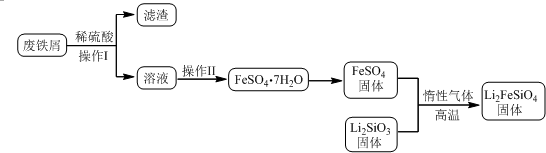
1.新型电池在飞速发展的信息技术中发挥着越来越重要的作用.Li2FeSiO4是极具发展潜力的新型锂离子电池电极材料,在苹果的几款最新型的产品中已经有了一定程度的应用.其中一种制备Li2FeSiO4的方法为:
固相法:2Li2SiO3+FeSO4$\frac{\underline{\;惰性气体\;}}{高温}$Li2FeSiO4+Li2SO4+SiO2
某学习小组按如下实验流程制备Li2FeSiO4并测定所得产品中Li2FeSiO4的含量.
实验(一)制备流程:
实验(二) Li2FeSiO4含量测定:
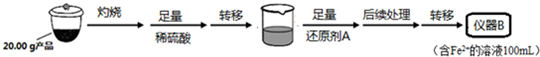
从仪器B中取20.00mL溶液至锥形瓶中,另取0.2000mol•Lˉ1的酸性KMnO4标准溶液装入仪器C中,用氧化还原滴定法测定Fe2+含量.相关反应为:MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O,杂质不与酸性KMnO4标准溶液反应.经4次滴定,每次消耗KMnO4溶液的体积如下:
(1)实验(一) 中:①操作Ⅱ的步骤为蒸发浓缩,降温结晶,过滤
②制备Li2FeSiO4时必须在惰性气体氛围中进行,其原因是防止二价铁被氧化
(2)实验(二) 中:①仪器名称:仪器C酸式滴定管
②还原剂A可用SO2,写出该反应的离子方程式SO2+2Fe3++2H2O=2Fe2++SO42-+4H+,此时“后续处理”主要为加热煮沸,其目的是除去过量的SO2,以免影响后面Fe2+的测定
③滴定终点时现象为溶液变为浅红色,且半分钟内不变色;根据滴定结果,可确定产品中Li2FeSiO4的质量分数为81.00%;若滴定前滴定管尖嘴处有气泡,滴定后消失,会使测得的Li2FeSiO4含量偏高(填“偏高”、“偏低”或“不变”).
固相法:2Li2SiO3+FeSO4$\frac{\underline{\;惰性气体\;}}{高温}$Li2FeSiO4+Li2SO4+SiO2
某学习小组按如下实验流程制备Li2FeSiO4并测定所得产品中Li2FeSiO4的含量.
实验(一)制备流程:

实验(二) Li2FeSiO4含量测定:

从仪器B中取20.00mL溶液至锥形瓶中,另取0.2000mol•Lˉ1的酸性KMnO4标准溶液装入仪器C中,用氧化还原滴定法测定Fe2+含量.相关反应为:MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O,杂质不与酸性KMnO4标准溶液反应.经4次滴定,每次消耗KMnO4溶液的体积如下:
| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗KMnO4溶液体积 | 20.00mL | 19.98mL | 21.38mL | 20.02mL |
②制备Li2FeSiO4时必须在惰性气体氛围中进行,其原因是防止二价铁被氧化
(2)实验(二) 中:①仪器名称:仪器C酸式滴定管
②还原剂A可用SO2,写出该反应的离子方程式SO2+2Fe3++2H2O=2Fe2++SO42-+4H+,此时“后续处理”主要为加热煮沸,其目的是除去过量的SO2,以免影响后面Fe2+的测定
③滴定终点时现象为溶液变为浅红色,且半分钟内不变色;根据滴定结果,可确定产品中Li2FeSiO4的质量分数为81.00%;若滴定前滴定管尖嘴处有气泡,滴定后消失,会使测得的Li2FeSiO4含量偏高(填“偏高”、“偏低”或“不变”).
2.反应A(g)?2B(?)+C(g)-Q已达到平衡,假设A、C状态始终保持不变,下列说法正确的是( )
| A. | 当混合气体的质量不变,说明反应已达到平衡状态 | |
| B. | 缩小容器体积,重新达到平衡时,气体平均相对分子质量不变或增大 | |
| C. | 在恒压容器中升高温度,气体混合物中C%可能先增大后减小 | |
| D. | 在恒容容器中升高温度,达到新平衡时,气体的密度可能增大 |
19.已知NO2为红棕色气体,而N2O4为无色气体,某温度下,反应N2O4(g)?2NO2(g);△H>0.在密闭容器中达到平衡,下列说法正确的是( )
| A. | 缩小容器体积,NO2体积分数减小,混合气体颜色变浅 | |
| B. | 保持容器体积不变,加入少许NO2,重新达到平衡时,NO2的体积分数增大 | |
| C. | 保持容器体积不变,加入少许N2O4再达到平衡时,气体颜色变深 | |
| D. | 保持容器体积不变,加入少许NO2,将使正反应速率减小 |
16.对于以下反应:A(s)+3B(g)?2C(g)+D(g),在一定温度、体积固定的密闭容器中进行,下列叙述中能说明上述反应达到平衡状态的是( )
| A. | 混合气体的密度不随时间变化而变化 | |
| B. | 3v正(B)=v逆(D) | |
| C. | D的物质的量分数在混合气体中保持不变 | |
| D. | B、C、D的分子个数之比为3:2:1 |